①5.000mol/L ②0.5000mol/L ③0.0500mol/L

实验编号 | 测稀盐酸的体积(mL) | 待滴氢氧化钠溶液前刻度 | 滴氢氧化钠溶液后刻度 |
1 | 20.00 | 5.00 | 22.00 |
2 | 20.00 | 4.50 | 21.52 |
3 | 20.00 | 5.20 | 22.18 |
测得的稀盐酸的物质的量浓度为mol/L。
①该温度时0.1mol/L NaOH溶液的pH为。
②该温度下,将pH=2的溶液与pH=9的NaOH溶液按体积比1∶9混合(忽略溶液体积变化),所得混合溶液的pH为。
③该温度下,若1体积的某强酸溶液与10体积
的某强碱溶液混合后溶液呈中性(忽略溶液体积变化),则混合前,a与b之间应满足的关系是。

①该氢氧化钠溶液的浓度为mol/L。
②在B点,溶液中离子浓度大小关系为。
③在D点,(填“<”“>”或“=”)
。
①常温下,0.1
溶液中
(填“>”“<”或“=”)
。
②常温下,实测某人血液中 ,
, 则人体血液呈
性。
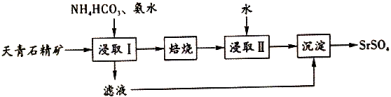
③浸取天青石精矿时,向溶液中加入适量浓氨水的目的是。
反应ⅰ:
反应ⅱ:
回答下列问题:
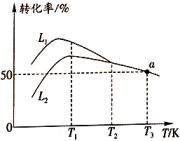
①曲线(填“”或“
”)表示丙烷的转化率。
②温度高于K后曲线
随温度升高而降低的原因为。
③当温度高于(填“”或“
”)时,可判断反应ⅱ不再发生的依据是。a点对应的温度下,丙烯的分压
kPa(保留3位有效数字,后同),反应ⅰ的平衡常数
kPa(以分压表示,分压=总压×物质的量分数)。