
实验操作步骤如下:
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%浓硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应。
请回答下列问题:
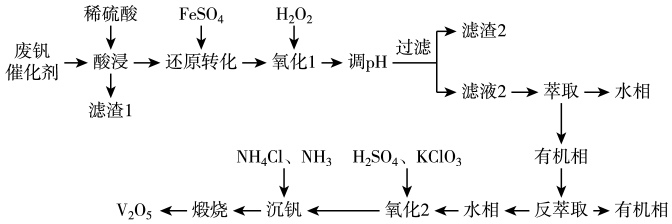
已知:
①“酸浸”时和
与稀硫酸反应分别生成
和
。
②溶液中与
可相互转化:
, 且
为沉淀。
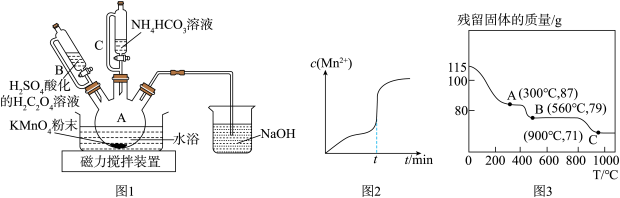
已知: MnCO3难溶于水、乙醇,100℃开始分解。 请回答下列问题:

已知:i.![]() +
+![]()
 (R、R′、R′′氢原子或烃基)
(R、R′、R′′氢原子或烃基)
ii.RCOOR′+R′′OHRCOOR′′+R′OH(R、R′、R′′代表烃基)
请回答下列问题:
①能与新制Cu(OH)2反应,生成砖红色沉淀 ②不含醚键
其中可发生水解反应,核磁共振氢谱显示4组峰,且峰面积之比为3∶2∶2∶1的结构简式为:。