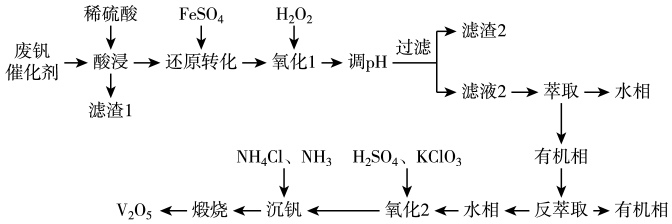
已知:
①“酸浸”时和
与稀硫酸反应分别生成
和
。
②溶液中与
可相互转化:
, 且
为沉淀。

已知:实验原理为。
将m g粗产品溶于无氧蒸馏水中配制成100 mL溶液,取20.00 mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5 min。用的
标准溶液进行滴定,加入指示剂,滴定至终点时,消耗
标准溶液。(杂质不与
反应,涉及的反应为
、
)
①加入的指示剂是(填名称)。
②C3N3O3Cl2Na的百分含量为(用含m、c、V的代数式表示)%。
③下列操作会导致粗产品中二氯异氰尿酸钠的纯度偏低的是(填标号)。
a.盛装Na2S2O3标准溶液的滴定管未润洗
b.滴定管在滴定前有气泡,滴定后无气泡
c.碘量瓶中加入的稀硫酸偏少
I.
II.
①则的
, 其中反应I能自发进行的条件是。
②保持温度T不变时,在容积不变的密闭容器中,充入一定量的及
, 起始及达到平衡时,容器内各气体的物质的量及总压强数据如表所示:
|
|
|
|
| 总压强/kPa | |
起始 | 0.5 | 0.9 | 0 | 0 | 0 | |
平衡 | m | 0.3 | p |
若反应I、II均达到平衡, , 则表中m=;反应I的平衡常数
(用含p的代数式表示)
。

已知:的产率
①下列说法正确的是(填标号)。
A.反应过程中,容器内压强不再变化,说明反应I达到平衡
B.反应过程中,气体密度保持不变,说明反应I达到平衡
C.反应过程中,气体的平均摩尔质量保持不变,说明反应I达到平衡
②图中500K以后,的平衡转化率随温度升高而增大的原因是。
 。此有机铜试剂中,C原子的杂化类型有,1mol此有机铜试剂中含有
。此有机铜试剂中,C原子的杂化类型有,1mol此有机铜试剂中含有