选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
A | 向浓盐酸中加入浓硫酸可制备氯化氢气体 | 浓盐酸易挥发,浓硫酸与水作用放出大量的热 | Ⅰ对,Ⅱ对;有 |
B | | | Ⅰ对,Ⅱ对;无 |
C | 硫单质在纯氧中燃烧有少量 | | Ⅰ对,Ⅱ对;无 |
D | 硝酸铵和碱石灰共热用于实验室制备 | 铵盐与碱能发生复分解反应 | Ⅰ对,Ⅱ对;有 |

已知:ZnO是两性氧化物;水解可制得
。在指定条件下,下列选项所示的物质间的转化能实现的是( )
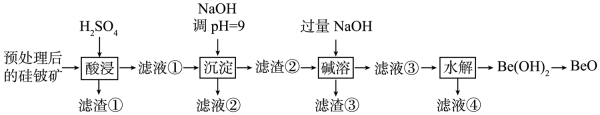
已知:Be(OH)2具有两性,在强碱性溶液中可转化为BeO。下列说法错误的是( )
选项 | 化学事实 | 类推结论 |
A |
|
|
B |
|
|
C |
|
|
D |
|
|
物质 | 用途 |
A.碳酸氢钠 | a.作呼吸面具供养剂 |
B.过氧化钠 | b.作食品膨松剂 |
C.漂粉精 | c.作红色颜料 |
D.氧化铁 | d.作游泳池消毒剂 |

试剂X可以是;若缺少C装置其后果是(写一条)。
(已知CuCl、CuSCN是难溶于水的白色固体)

请从平衡角度说明红色褪去的可能原因。

①如图蓝色溶液中可能含有的盐有Cu(NO3)2、。
②实验中CuSCN与过量稀HNO3反应生成白色沉淀B的阴离子,同时生成N2、NO和CO2气体。CuSCN与HNO3反应中还原剂与氧化剂的物质的量之比为(已知SCN-中C为+4价)。

_+_H2O2+_=_Mn2++_H2O+_
制备流程图如下:

将废铁屑分批加入稀盐酸中,至盐酸反应完全。判断反应完全的现象为。含有少量铜的废铁屑比纯铁屑反应快,原因为。
将与液体
混合并加热,制得无水
。已知
沸点为77℃,反应方程式为:
, 装置如下图所示(夹持和加热装置略)。

仪器A的名称为,其作用为。NaOH溶液的作用是。
a. b.
c.
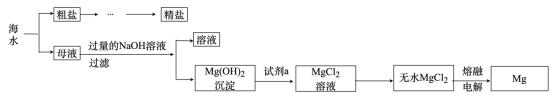
①过滤 ②加过量溶液 ③加适量盐酸 ④加过量
溶液 ⑤加过量
溶液
请回答:

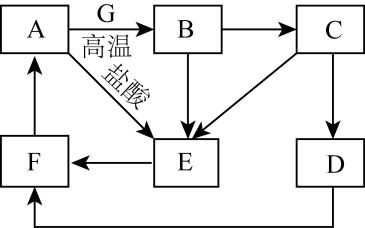
回答下列问题:
①在配制C溶液时需加入少量铁屑,其目的是。
②在配制过程中,下列不正确操作会导致所配溶液浓度(填“偏高”“偏低”或“无影响”)
a、用托盘天平称量时,左盘放砝码,并且使用游码:;
b、烧杯和玻璃棒未洗涤:;
c、定容时俯视刻度线:。