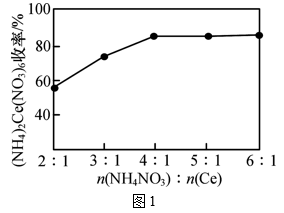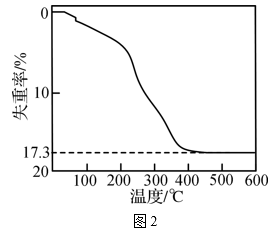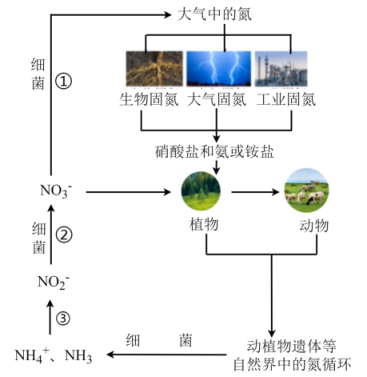
第一步:
第二步:
第三步:
①在该反应中,氧化剂与还原剂的物质的量之比是;
②若在反应中生成了标况下2.24L氯气,则电子转移的个数是NA。
①用双线桥表示上述反应中电子转移的方向和数目;
②浓盐酸在该反应中表现的性质是(填序号);
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③该反应的还原产物是(填化学式);
④上述反应产生0.1molCl2时,转移电子的物质的量为。
已知发生的反应为:C6H8O6+I2=C6H6O6+2H++2I- , 2S2O32-+I2=S4O62-+2I-
该溶液中维生素C的物质的量是多少mol?(写出简要的计算过程)。
实验记录如下:
|
|
实验现象 |
|
|
实验Ⅰ |
|
极少量 |
|
实验Ⅱ |
|
部分 |
|
实验Ⅲ |
|
|
初始阶段,
被氧化的反应速率:实验Ⅰ
填“
”“
”或“
”
实验Ⅱ。
实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
蓝色
或
无色
, 进行以下实验探究:
步骤取实验Ⅲ的深红棕色溶液,加入
, 多次萃取、分液。
步骤取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
步骤
的目的是。
查阅资料,
,
无色
容易被空气氧化。用离子方程式解释步骤
的溶液中发生的变化:。
结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是
, 实验Ⅰ中铜被氧化的化学方程式是。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓
溶液,
填实验现象
, 观察到少量红色的铜。分析铜未完全反应的原因是。

物质 | | | |
沸点/ | 57.7 | 12.8 | 33.0 |
熔点/ | | | |
回答下列问题:

①仪器a的名称为,装置B中的试剂为。
②将装置C水浴加热,该加热方式的优点是。
③为保证实验安全,加热装置D前必须完成的操作是:ⅰ.检验装置的气密性;ⅱ.,该装置中发生反应的化学方程式为。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强,数值越小,还原性越强。
测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
| 物质 | H2O2 | H2O2(酸化) | FeCl3 | KMnO4(酸化) | NaNO3(酸化) | NaBr | KI | Na2S |
| 浓度 | 5% | 5% | 0.1mol•L-1 | |||||
| 电位值/mV | 276 | 683 | 671 | 1130 | 603 | 362 | 116 | -361 |
根据表中数据,回答下列问题:
①FeCl3 ②酸性KMnO4 ③酸性NaNO3
a.Fe3+、Br- b.Fe3+、S2- c.NO、H+、I- d.H+、MnO
、I-
猜想1:_▲_。
猜想2:I2被氯水继续氧化
查阅资料:HClO不能漂白淀粉与I2结合形成的蓝色物质。
| 序号 | 实验操作 | 试剂 | 现象 | 结论 |
| 1 | 分别取少量褪色的溶液于三支试管中,并加入对应试剂,观察实验现象 | a | _▲_ | 猜想1不正确 |
| 2 | 淀粉溶液 | 溶液不变蓝 | 猜想2正确(I2被氧化为IO | |
| 3 | b+稀H2SO4 | 溶液变蓝 |
①猜想1为,实验1所用试剂a为,实验1的现象为。
②实验3所用试剂b是一种可溶性含碘化合物,该反应的离子方程式为。