|
物质的熔沸点 |
|||
|
物质 |
CS2 |
CCl4 |
S2Cl2 |
|
沸点/℃ |
47 |
77 |
137 |
|
熔点/℃ |
-109 |
-23 |
-77 |

在圆底烧瓶中加入12.2g苯甲酸和13g甲醇,再加入2mL浓硫酸,混匀后,投入几粒沸石,小心加热65min,获得苯甲酸甲酯粗产品。

有关数据如表所示:
|
摩尔质量/g•mol-1 |
熔点/℃ |
沸点/℃ |
密度/g•cm-3 |
水溶性 |
|
|
苯甲酸 |
122 |
122.4 |
249 |
1.27 |
微溶 |
|
甲醇 |
32 |
-97 |
64.3 |
0.79 |
互溶 |
|
苯甲酸甲酯 |
136 |
-12.3 |
199.6 |
1.09 |
不溶 |
请回答下列问题:

已知信息: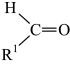
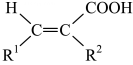 (R1=芳基)
(R1=芳基)
请回答下列问题:
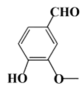 )有多种同分异构体,其中能同时满足下列条件的芳香族化合物的结构简式为。
)有多种同分异构体,其中能同时满足下列条件的芳香族化合物的结构简式为。①可发生银镜反应,也能与FeCl3溶液发生显色反应;
②核磁共振氢谱有四组峰,峰面积比为1:2:2:3。
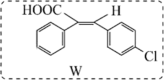 )的合成路线。(无机试剂和四个碳以下的有机试剂任选)
)的合成路线。(无机试剂和四个碳以下的有机试剂任选)