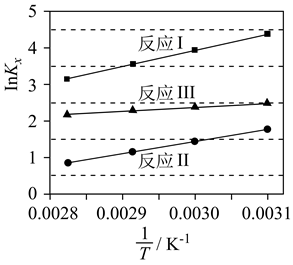
已知:
C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) △H=-2043.9kJ/mol
C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(g) △H=-1926.1kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ/mol
下列说法错误的是( )
①CuSO4+H2S=CuS↓+H2SO4
②11PH3+24CuSO4+12H2O=3H3PO4+24H2SO4+8Cu3P↓
下列分析错误的是( )


① 为浅紫色,但溶液Ⅰ却呈黄色,其原因是,为了能观察到溶液Ⅰ中
的浅紫色,可采取的方法是。
②已知Fe3+与SCN-、F-的反应在溶液中存在以下平衡: ;
,向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为,平衡常数为(用K1和K2表示)。
Ⅰ.主反应: ![]() (g)+3H2(g)⇌
(g)+3H2(g)⇌  (g) ∆H1<0
(g) ∆H1<0
Ⅱ.副反应:  (g) ⇌
(g) ⇌ ![]() (g) ∆H2>0
(g) ∆H2>0
回答下列问题:
Ⅳ.2  (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
Ⅴ.  (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
则 (用
、
和
表示)。


②结合电极反应式说明生成溶液a的原理。
电解效率η和选择性S的定义:
η(B)= ×100%
S(B)= ×100%
①若η(EO)=100%,则溶液b的溶质为。
②当乙烯完全消耗时,测得η(EO)≈70%,S(EO)≈97%,推测η(EO)≈70%的原因:
I.阳极有H2O放电
II.阳极有乙烯放电
III.阳极室流出液中含有Cl2和HClO
……
i.检验电解产物,推测I不成立。需要检验的物质是。
ii.假设没有生成EO的乙烯全部在阳极放电生成CO2 , η(CO2)≈%。经检验阳极放电产物没有CO2。
iii.实验证实推测III成立,所用试剂及现象是。
可选试剂:AgNO3溶液、KI溶液、淀粉溶液、品红溶液。
①反应的离子方程式是。
②电极反应式:
i还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii氧化反应:。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱.
ii随c(Cl-)降低,。
④补充实验证实了③中的分析。
|
实验操作 |
试剂 |
产物 |
|
|
I |
| 较浓H2SO4 | 有Cl2 |
| II | a | 有Cl2 | |
| III | a+b | 无Cl2 |
a是,b是。
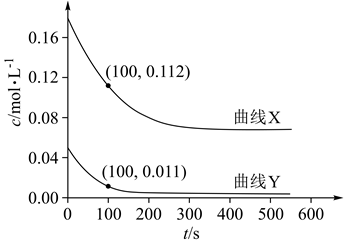
实验I:将0.0100 mol/L Ag2SO4溶液与0.0400 mo/L FeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验II:向少量Ag粉中加入0.0100 mol/L Fe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实沉淀为Ag。现象是。
②II中溶液选用Fe2(SO4)3 , 不选用Fe(NO3)3的原因是。
综合上述实验,证实“Ag++Fe2+ Fe3++Ag”为可逆反应。
③小组同学采用电化学装置从平衡移动角度进行验证。补全电化学装置示意图,写出操作及现象。

实验Ⅲ:一定温度下,待实验Ⅰ中反应达到平衡状态时,取v mL上层清液,用c1 mol/L KSCN标准溶液滴定Ag+ , 至出现稳定的浅红色时消耗KSCN标准溶液v1 mL。
资料:Ag++SCN- AgSCN↓(白色) K=1012
Fe3++SCN- FeSCN2+(红色) K=102.3
①滴定过程中Fe3+的作用是。
②测得平衡常数K=。
①取实验I的浊液测定c(Ag+),会使所测K值(填“偏高”“偏低”或“不受影响”)。
②不用实验II中清液测定K的原因是。
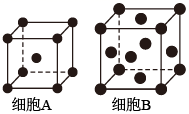
![]() 资料:
资料:
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O⇌TiO2·xH2O↓+H2SO4
iii.0.1 mol/L Fe2+生成Fe(OH)2 , 开始沉淀时pH=6.3,完全沉淀时pH=8.3;
0.1 mol/L Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
①加入过量铁粉的目的是。
②充分反应后,分离混合物的方法是。
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如图)。

①产生白色沉淀的离子方程式是。
②产生白色沉淀后的pH低于资料iii中的6.3。原因是:沉淀生成后c(Fe2+)0.1mol/L(填“>”“=”或“<”)。
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:。
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:。
铁黄纯度可以通过产品的耗酸量确定。
wg铁黄 溶液b
溶液c
滴定
资料:Fe3++3 =Fe(C2O4)
,Fe(C2O4)
不与稀碱液反应
Na2C2O4过量,会使测定结果(填“偏大”“偏小”或“不受影响”)


中和时pH的理论范围为;酸化的目的是;Fe元素在(填操作单元的名称)过程中除去。

反应Ⅰ: ![]() +CH3OH
+CH3OH
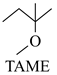 △H1
△H1
反应Ⅱ: ![]() +CH3OH
+CH3OH
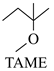 △H2
△H2
反应Ⅲ: ![]()
![]() △H3
△H3
回答下列问题:
A.<-1 B.-1~0 C.0~1 D.>1