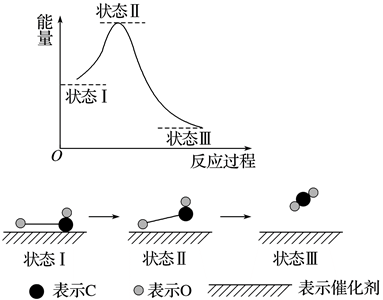
熔点:MgO 2800℃;MgCl2 712℃。
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
在0~1 min、1~2 min、2~3min、3~4 min、4~5 min时间段中,反应速率最大的时间段是,原因为。
①x=。
②反应经2 min达到平衡,平衡时C的浓度(填“大于”、“小于”或“等于”)1 mol/L。
③达到平衡时,容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达到平衡时反应物A的转化率:。

a.甲、乙都是碱石灰
b.甲、乙都是无水氯化钙
c.甲是碱石灰,乙是五氧化二磷
d.甲是五氧化二磷,乙是碱石灰