

已知:0.1mol·L-1Fe3+生成Fe(OH)3 , 开始沉淀时pH=1.5,完全沉淀时pH=2.8
下列说法错误的是( )
已知:i.银氨溶液用2%AgNO3溶液和稀氨水配制
ii.[Ag(NH3)2]++2H2O⇌Ag++2NH3·H2O
| 序号 | ① | ② | ③ | ④ |
| 装置 | | | | |
| 现象 | 一直无明显现象 | 8min有银镜产生 | 3min有银镜产生 | d中较长时间无银镜产生,e中有银镜产生 |
下列说法错误的是( )

①根据测定H2O2分子中(填字母序号),确定其结构一定不是甲。
a.H-O键长 b.O-O键能 c.H-O-O键角
②由于H2O2不稳定,很难得到晶体。20世纪40年代初,卢嘉锡等化学家用尿素( ![]() )与H2O2形成较稳定的尿素过氧化氢复合物晶体,进而测得H2O2结构为乙。上述晶体中尿素与H2O2分子交替排列且二者中的O均与另外分子的H之间形成氢键。
)与H2O2形成较稳定的尿素过氧化氢复合物晶体,进而测得H2O2结构为乙。上述晶体中尿素与H2O2分子交替排列且二者中的O均与另外分子的H之间形成氢键。
a.H2O2为(填“极性”或“非极性”)分子。
b.用“X—H…Y”表示出上述晶体中形成的氢键:。

根据图中信息,可计算O2晶体密度是g·cm-3。
①补全反应的离子方程式。
口Au+口 +O2+口
![]() =口[Au(S2O3)2]3-+口
=口[Au(S2O3)2]3-+口 ![]()
②简述 在金被氧化过程中的作用:。
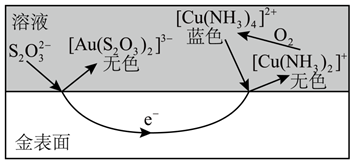
①上述原理可知,[Cu(NH3)4]2+在浸金过程中起作用。
②为了验证上述原理中O2的作用,进行如下实验。
实验现象:反应一段时间后,温度无明显变化,U形管内液柱左高右低,锥形瓶中溶液蓝色变浅,打开瓶塞后……
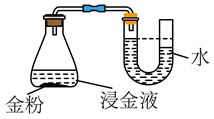
a.打开瓶塞后,(填实验现象),证实了上述原理。
b.a中现象对应反应的离子方程式是。
③下图表示相同时间内,配制浸金液的原料中c(CuSO4)对浸金过程中 消耗率和浸金量的影响(其他条件不变)。
已知:2Cu2++6 ⇌2[Cu(S2O3)2]3-+
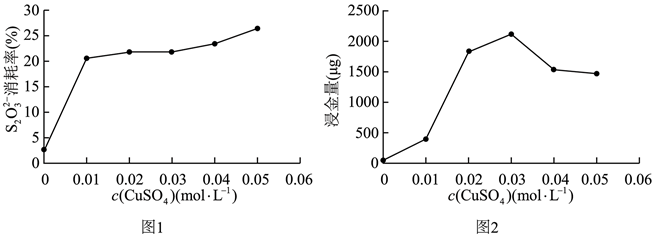
结合图1,解释图2中浸金量先上升后下降的原因:。
【实验I】向2 mL0.1 mol·L-1FeSO4溶液中滴加几滴0.1 mol·L-1KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用H2SO4酸化至pH=1),溶液颜色变红。
乙同学查阅资料发现Fe2+与SCN-也可发生反应,生成无色的配合物。为证实该性质,利用FeCO3进行如下实验。

通过实验b排除了的干扰。
丙同学设计实验进一步证明Fe2+可与SCN-反应。

上述实验中,d为c的对照实验。
①X为。
②实验能够证实Fe2+可与SCN-反应,则应观察到的现象是。
Mn在(填“阳极”或“阴极”)生成。
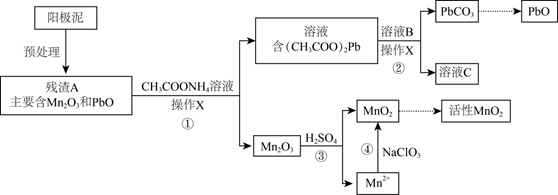
已知:(CH3COO)2Pb在水中难解离。
操作X为。
b.加入NaClO3前,需将溶液pH调大至6左右。调节pH的目的是。
i.用V1mLc1mol∙L-1Na2C2O4溶液(H2SO4)酸化)溶解wg活性MnO2样。品。(MnO2+ +4H+=2CO2↑+Mn2++2H2O)
ii.用c2mol∙L-1酸性KMnO4标准溶液滴定i中剩余的 消耗KMnO4标准溶液V2mL。(5
+2
+16H+=2Mn2++10CO2↑+8H2O)
样品中MnO2的质量分数=[M(MnO2)=87g·mol-1]。