Mn在(填“阳极”或“阴极”)生成。
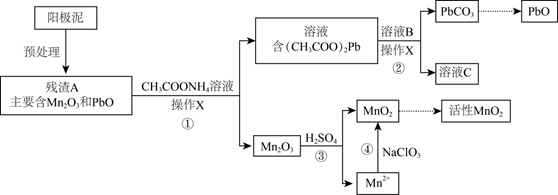
已知:(CH3COO)2Pb在水中难解离。
操作X为。
b.加入NaClO3前,需将溶液pH调大至6左右。调节pH的目的是。
i.用V1mLc1mol∙L-1Na2C2O4溶液(H2SO4)酸化)溶解wg活性MnO2样。品。(MnO2+ +4H+=2CO2↑+Mn2++2H2O)
ii.用c2mol∙L-1酸性KMnO4标准溶液滴定i中剩余的 消耗KMnO4标准溶液V2mL。(5
+2
+16H+=2Mn2++10CO2↑+8H2O)
样品中MnO2的质量分数=[M(MnO2)=87g·mol-1]。