 B .
B .  C .
C . 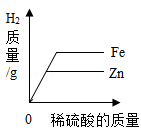 D .
D . 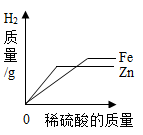
②向滤液中加入稀盐酸,一定有沉淀产生。 ③滤渣中一定含有Ag,可能有Fe。 ④滤液中一定含有Fe(NO3)2 , 一定不含AgNO3 , 可能含有Al(NO3)3。以上说法正确的个数为( )

 B .
B .  C .
C .  D .
D . 

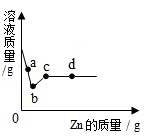
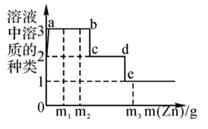
①ab、bc ②bc、cd ③ab、cd



请回答下列问题:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
烧杯中的质量/g | 26 | 46 | 65.9 | 85.8 | 105.8 |

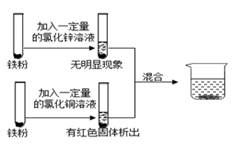
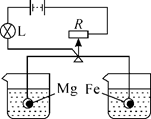
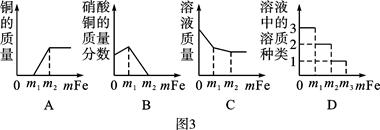
实验Ⅰ:硫酸铝溶液和铁粉混合;
实验Ⅱ:硫酸铜溶液与铁粉混合。
在上述两个实验结束后,该同学将实验Ⅰ和Ⅱ的物质全部倒入同一个烧杯中,发现烧杯内的红色固体明显增多,原因是(用文字说明)。一段时间后过滤,向滤渣中滴加盐酸,结果没有气泡产生。那么,滤液中所含金属离子的情况可能是 (填序号)。
①Al3+②Al3+、Fe2+③Al3+、Fe3+
④Fe2+、Cu2+⑤Al3+、Fe2+、Cu2+
|
反应时间(秒) |
20 |
40 |
60 |
80 |
100 |
120 |
140 |
|
|
收集到的气体体积(毫升) |
甲金属 |
25 |
60 |
95 |
130 |
160 |
170 |
170 |
|
乙金属 |
30 |
75 |
120 |
150 |
150 |
150 |
150 |
|
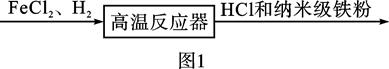
高温反应器中反应的化学方程式为。反应前需向反应器中通入氮气,目的是;


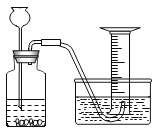
①连接好装置;②检查装置气密性;③装入药品;④ ;⑤D 中黑色固体完全反应变成红色后,停止加热;⑥待 D 中玻璃管冷却至室温,关闭分液漏斗活塞;⑦数据处理。



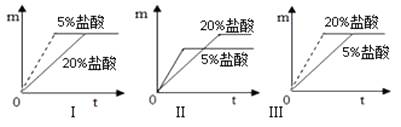
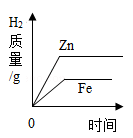
量分数的盐酸反应,反应的快慢不同。取质量相等的铝片,分别放入5%、20%的足量稀盐酸中。实验表明盐酸浓度越大,反应进行越快。如图Ⅰ、Ⅱ、Ⅲ是三位同学记录实验生成氢气的质量(m)
与反应时间(t)的关系曲线,其中正确的是。
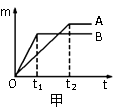
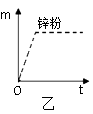
(m)与反应时间(t)的关系曲线如图乙所示,请在答题卡的该图上用实线“——”补画出锌片与盐酸反应生成氢气的质量(m)与反应时间(t)的关系曲线。