

 B .
B .  C .
C .  D .
D . 



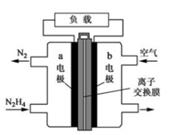
该电池的正极是(填“a电极”或“b电极”),电极反应式为,该电极上的物质发生反应的反应类型是(填“氧化反应”或“还原反应”)。



①电极b是正极
②外电路中电子由电极b通过导线流向电极a
③该电池的总反应:2H2+O2=2H2O
Ⅰ.CO与H2反应合成甲醇
Ⅱ.CO2与H2反应合成甲醇 CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
a.单位时间消耗nmolCO2的同时,消耗3n mol的H2
b.容器内CH3OH的浓度不再改变
c.容器内气体压强不再改变
d.容器内气体密度不再改变
|
化学键 |
H-H |
C-O |
CO中的 C | H-O | C-H |
| E(kJ) | m | n | E1 | x | y |
根据相关数据计算拆开1molC ![]() O所需的能量E1=kJ。
O所需的能量E1=kJ。

通入H2 的一端是电池的极(填“正”或“负”),通入CO2的一端发生的电极反应式为。