温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
溶解度/g | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 |

选项 | 操作 | 目的 |
A | 用剩的食盐放回原试剂瓶 | 避免浪费 |
B | 天平调平后在左、右托盘各垫一张相同的纸 | 保证称取的食盐质量更准确 |
C | 用50mL量筒替代天平量取所需的水 | 更加简便 |
D | 溶解时用玻璃棒搅拌 | 增加食盐的溶解能力 |


温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
氯化铵溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
氯化钠溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 氯化钠溶解度(克) | 35.8 | 36.0 | 36.3 | 36.4 | 37.0 | 37.3 | 37.8 |
| 硝酸钾溶解度(克) | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
请你参与实验室配制一定溶质质量分数的硝酸钾溶液的实验,并进行实验过程的探究:

A.先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡.
B.先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡.
【探究一】:在称量过程中,某同学的称量操作如图所示,你认为该操作对本次实验的数据处理的正确性 (填“有”或“没有”)影响,理由是 .
(3)量取:准确量取所需蒸馏水要用到的仪器是 (选填图中的标号).

【探究二】:20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出计算所需的数据为: g/mL.
温度℃ 质量分数% | 20 | 40 | 60 |
4 | 1.023 | 1.016 | 1.007 |
10 | 1.063 | 1.054 | 1.044 |
因素 | 第一组 | 第二组 | 第三组 | ||
实验温度 | 20℃ | 20℃ | 20℃ | 20℃ | 80℃ |
加入溶剂种类 | 水 | 酒精 | 水 | 水 | 水 |
加入溶剂质量 | 20g | 20g | 10g | 10g | 10g |
加入固体种类 | 硝酸钾 | 硝酸钾 | 硝酸钾 | 食盐 | 硝酸钾 |
加入固体质量 | 10g | 10g | 10g | 10g | 10g |
溶解固体质量 | 6.2g | 0g | 3.1g | 3.6g | 10g |
①温度 ②加入溶剂种类 ③加入溶剂质量 ④加入固体种类 ⑤加入固体质量
①用电子天平称取 10.0g 硝酸钾,放入烧杯中;
②量取 10.0mL 水,倒入上述烧杯中,称量烧杯、硝酸钾和水的总质量为 m1g;
③搅拌至硝酸钾不再溶解为止;
④过滤,称量所得硝酸钾溶液和烧杯的总质量为 m2g;
⑤计算:m1-m2=g(结合第二组实验数据进行分析)。 将溶质改为食盐,重复上述步骤进行实验。
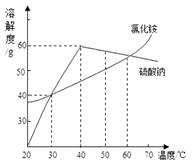
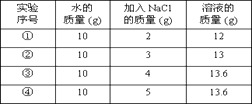
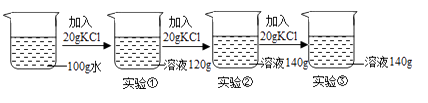
由实验可知,20℃时食盐的溶解性(填“>”“﹦”“<”)硝酸钾的溶解性。