将盛有H2O2溶液和氨水混合液的三颈烧瓶置于冷水浴中,在搅拌下滴入CaCl2溶液,析出固体CaO2·8H2O。对所得固体过滤,用5mL无水乙醇洗涤2 3次,转移至坩埚于烘箱内105℃下脱水干燥,冷却后称重,得产品CaO2。回答下列问题:
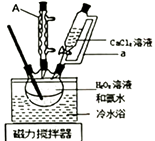
检查装置气密性后,精确称取m g过氧化钙样品加入试管中,调整甲管内液面读数在0-1mL之间,并与乙管的液面相平,记下甲管内液面的初读数V1mL。加热,过氧化钙逐渐分解放出氧气,完全分解,停止加热冷却至室温后,使甲乙两管的液面相平,记下甲管内液面的终读数V2mL,设在此温度和压强下气体摩尔体积为VmL·mol-1 , 则样品中CaO2的质量分数为%。
已知:溶解度表:
Li2CO3 | LiOH | LiI | |
0℃ | l.54g | 12.7g | 151g |
100℃ | 0.72g | 13.6g | 179g |
回答下列问题:
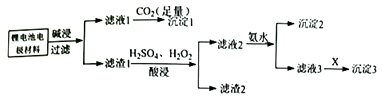
a.加入H2O2溶液适当过量,有利于滤渣1的转化
b.适当提高硫酸溶液浓度并搅拌
c.用HNO3代替所加H2SO4和H2O2 , 节约药品更环保
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
b.升高温度
c.使用优质催化剂
d.增大CO的浓度
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=,该条件下的平衡常数K=。
②第15 min后,温度调整到T2 , 数据变化如上表所示,则T1 T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=。
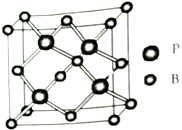
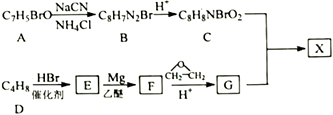
已知:
①核磁共振氢谱显示A有3种化学环境的氢,E只有1种化学环境的氢;
② ![]()
③ ![]()
回答下列问题:
①苯环上有两个取代基;
②能发生银镜反应,且在碱性条件下水解的两种产物也能发生银镜反应。