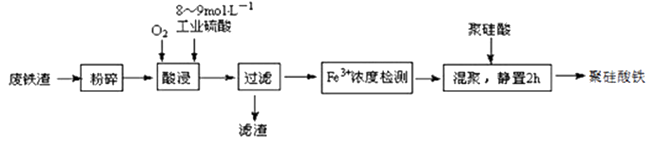
已知:在一定温度下酸浸时Fe3+在pH=2 开始沉淀,pH=3.7 沉淀完全
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式②硫酸酸浸时应控制溶液的pH,其原因是。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是。
CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH>0
|
物质 |
CH4(g) |
CO(g) |
H2(g) |
|
燃烧热(kJ·mol-1) |
890.3 |
283.0 |
285.8 |
① ΔH=kJ·mol-1
② 用Ni基双金属催化,反应的活化能降低,ΔH(填“变大”、“变小”或者“不变”)
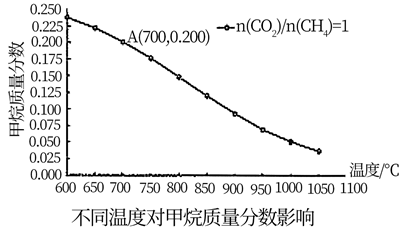
若充入a molCH4 , 经过2小时后达到如右图A点,2小时内用CH4表示的平均反应速率为mol/h(用a表示);假设A为平衡态,此时压强为2MPa,平衡常数Kp=(用平衡分压代替平衡浓度,分压=总压x物质的量分数,保留2位小数)。
a.增加甲烷的浓度,η增大 b.增加CO2浓度,η增大
c.及时分离合成气,η增大 d.通过升高温度,提升k
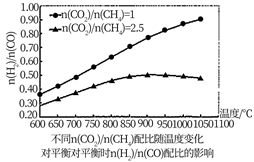
按n(CO2)/n(CH4)=2.5的配比进料,随温度升高,合成气n(H2)/n(CO)配比“先增加后减小”。增加是因为高温有利甲烷分解的积碳反应,请解释“减小”的可能原因。
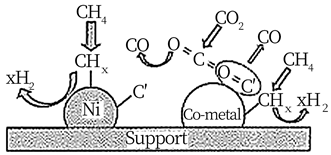
结合图示:
①写出一个可能的积碳反应方程式。
② 金属钴能有效消碳的原因是。
①直接脱氢:
②
计算氧化丙烷脱氢反应③
的
。
化学键 | |||
键能 | 347.7 | 413.4 | 436.0 |
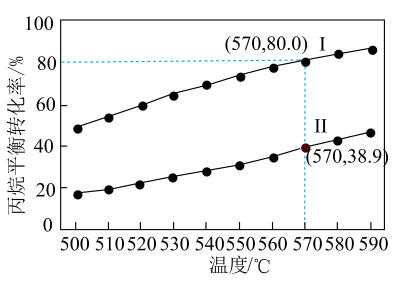
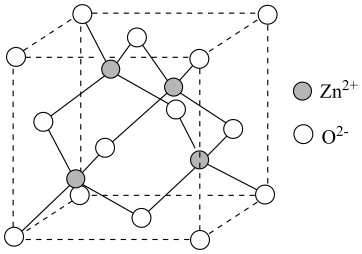
已知:反应Ⅰ.2NO(g)+O2(g) 2NO2(g)
-112 kJ·mol-1;
反应Ⅱ.2NO2(g) N2O4(g)
-24.2 kJ·mol-1;
反应Ⅲ.3O2(g) 2O3(g)
+144.6 kJ·mol-1;
②平衡时O2的转化率α(O2)30%(填“>”“=”或“<”)。
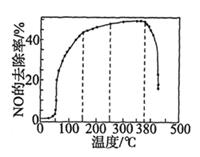
②一定温度下,按进料比n(NH3):n(NO) =1:1,匀速通入装有锰、镁氧化物作催化剂的反应器中反应。反应相同时间,NO的去除率随反应温度的变化曲线如上图。NO的去除率先迅速上升后上升缓慢的主要原因是;当反应温度高于380℃时,NO的去除率迅速下降的原因可能是。