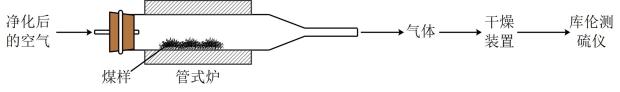
已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含。
已知:库仑测硫仪中电解原理示意图如下。检测前,电解质溶液中保持定值时,电解池不工作。待测气体进入电解池后,
溶解并将
还原,测硫仪便立即自动进行电解到
又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。

①在电解池中发生反应的离子方程式为。
②测硫仪工作时电解池的阳极反应式为。
已知:电解中转移电子所消耗的电量为96500库仑。
①测定过程中,需控制电解质溶液 , 当
时,非电解生成的
使得测得的全硫含量偏小,生成
的离子方程式为。
②测定过程中,管式炉内壁上有残留,测得全硫量结果为。(填“偏大”或“偏小”)
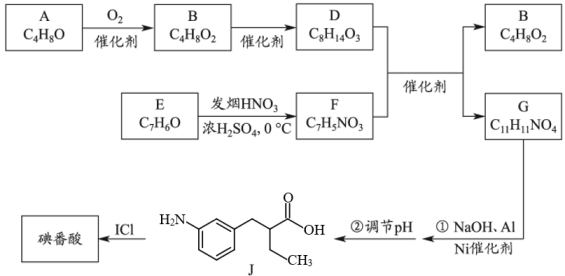
已知:R1COOH+R2COOH![]() +H2O
+H2O
步骤一:称取amg口服造影剂,加入Zn粉、NaOH溶液,加热回流,将碘番酸中的碘完全转化为I- , 冷却、洗涤、过滤,收集滤液。
步骤二:调节滤液pH,用bmol∙L-1AgNO3标准溶液滴定至终点,消耗AgNO3溶液的体积为cmL。
已知口服造影剂中不含其它含碘物质。计算口服造影剂中碘番酸的质量分数。
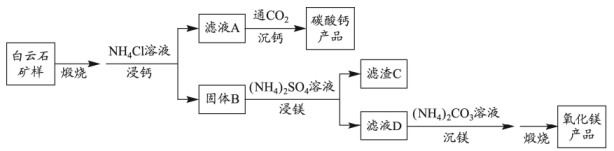
已知:
物质 | ||||
氧化物( | 产品中 | 产品中Mg杂质含量/% (以 | |||
计算值 | 实测值 | ||||
2.1∶1 | 98.4 | 1.1 | 99.1 | 99.7 | —— |
2.2∶1 | 98.8 | 1.5 | 98.7 | 99.5 | 0.06 |
2.4∶1 | 99.1 | 6.0 | 95.2 | 97.6 | 2.20 |
备注:ⅰ、浸出率=(浸出的
质量/煅烧得到的
质量)
(M代表Ca或Mg)
ⅱ、纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度。
①解释“浸钙”过程中主要浸出的原因是。
②沉钙反应的离子方程式为。
③“浸钙”过程不适宜选用的比例为。
④产品中纯度的实测值高于计算值的原因是。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、(绿色)、
(紫色)。
ii.浓碱条件下,可被OH-还原为
。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)

序号 | 物质a | C中实验现象 | |
通入Cl2前 | 通入Cl2后 | ||
I | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
II | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
III | 40%NaOH 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将氧化为
。
①化学方程式表示可能导致溶液碱性减弱的原因,但通过实验测定溶液的碱性变化很小。
②取III中放置后的1 mL悬浊液,加入4 mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为,溶液绿色缓慢加深,原因是MnO2被(填“化学式”)氧化,可证明III的悬浊液中氧化剂过量;
③取II中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因。