CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH>0
|
物质 |
CH4(g) |
CO(g) |
H2(g) |
|
燃烧热(kJ·mol-1) |
890.3 |
283.0 |
285.8 |
① ΔH=kJ·mol-1
② 用Ni基双金属催化,反应的活化能降低,ΔH(填“变大”、“变小”或者“不变”)
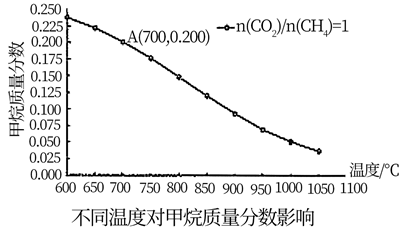
若充入a molCH4 , 经过2小时后达到如右图A点,2小时内用CH4表示的平均反应速率为mol/h(用a表示);假设A为平衡态,此时压强为2MPa,平衡常数Kp=(用平衡分压代替平衡浓度,分压=总压x物质的量分数,保留2位小数)。
a.增加甲烷的浓度,η增大 b.增加CO2浓度,η增大
c.及时分离合成气,η增大 d.通过升高温度,提升k
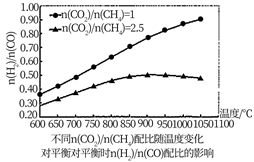
按n(CO2)/n(CH4)=2.5的配比进料,随温度升高,合成气n(H2)/n(CO)配比“先增加后减小”。增加是因为高温有利甲烷分解的积碳反应,请解释“减小”的可能原因。
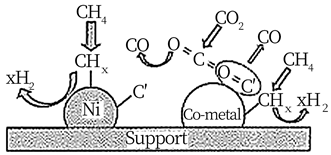
结合图示:
①写出一个可能的积碳反应方程式。
② 金属钴能有效消碳的原因是。