

 C . PH3的电子式为
C . PH3的电子式为
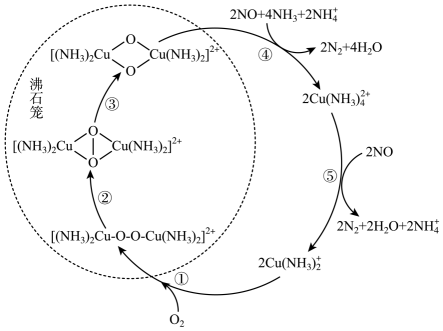
回答下列问题:
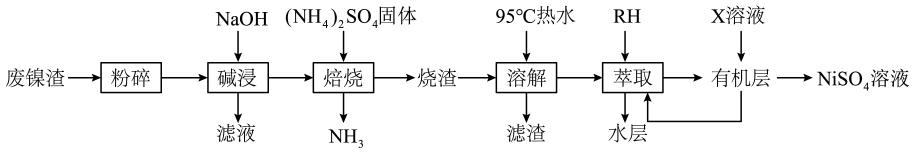
萃取率/% | 0.1 | 0.15 | 0.2 | 0.25 | 0.3 | 0.35 | 0.4 |
Ni2+ | 55% | 68% | 80% | 99% | 99.5% | 99.8% | 99.9% |
Fe2+ | 2% | 2% | 4% | 5% | 8% | 30% | 58% |
②物质X的化学式为。


144.5g二丁二酮肟合镍分子内含有σ键mol,碳碳键是由轨道重叠形成的。
a. sp3和sp2 b. sp2和 sp2 c. sp2和p d. sp3和p
a.离子键 b.金属键 c.配位键 d.极性共价键

①甘氨酸铜中铜原子的杂化类型为(填“”或“
”)。
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是。
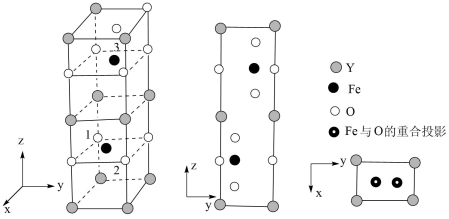
一个晶胞中有个O。已知1号O原子分数坐标为 , 2号O原子分数坐标为
, 则3号Fe原子的分数坐标为。
a.离子键
b.c金属键
c.配位键
d.极性共价键

①甘氨酸铜中铜原子的杂化类型为(填“sp”或“dsp?” )。
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是。

一个晶胞中有个O。已知1号O原子分数坐标为(0, 0,),2号O原子分数坐标为(
,
-m,
-n),则3号Fe原子的分数坐标为。

 与
与 按一定比例调配而成的,其与
按一定比例调配而成的,其与a.离子键|b.极性共价键|c.非极性共价键 d.配位键


①Mg原子周围距离最近且相等的Ni原子有个,若晶胞边长为646pm,则Mg—Ni核间距为pm(结果保留小数点后两位,取1.73)。
②若以晶胞中氢的密度与液态氢密度之比定义储氢材料的储氢能力,则该化合物的储氢能力为(列出计算式即可。假定该化合物中所有的H可以全部放出,液氢密度为dg•cm-3;设NA代表阿伏加德罗常数的值)。
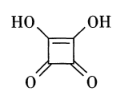
①1 mol方酸中含有的σ键数目为,其中 C的杂化轨道类型是。
②羧基中的羟基极性越大,越易电离出H+。三氟乙酸(CF3COOH)的酸性大于三氯乙酸(CCl3COOH),试从键的极性分析其原因可能是。
①LiClO4中阴离子的空间结构名称是。
②是一种配离子,请从配位键来解释其形成过程:。
③LiPF6在一定条件下可分解生成PF5比较PF5和PCl5的热分解温度高低,利用键参数说明理由:。
 , H2O,CH3OCH3;Y代表Cl,Br)。锂键和氢键类似,但也有不同,下列有关说法错误的是____(填字母)。
, H2O,CH3OCH3;Y代表Cl,Br)。锂键和氢键类似,但也有不同,下列有关说法错误的是____(填字母)。
 分子间能形成氢键, CH3OCH3分子间不能形成氢键
分子间能形成氢键, CH3OCH3分子间不能形成氢键
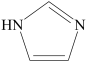 。分子中的大π键可用符号π
。分子中的大π键可用符号π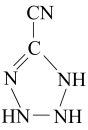 中孤电子对与π键比值为,碳原子的杂化方式为。
中孤电子对与π键比值为,碳原子的杂化方式为。
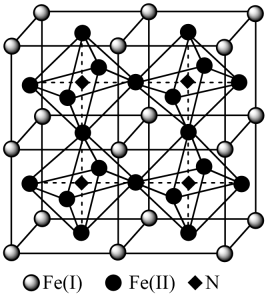
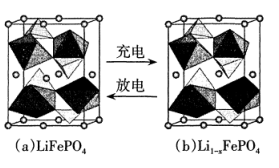
①写出氮化铁中铁的堆积方式为。
②该化合物的化学式为。
③计算出Fe(II)围成的八面体的体积为cm3。
已知。回答下列问题:
a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键

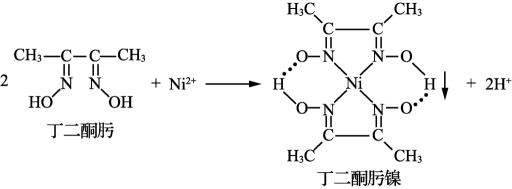
①基态核外电子排布式为。
②丁二酮肟镍分子中采取
杂化,为平面正方形构型,则该分子中共面的原子最多为个。
③丁二酮肟镍分子内存在的化学键有(填标号)。
A.离子键 B.配位键 C.氢键 D.范德华力
①晶体中含有的
键与
键数目之比为。
②中键角H-N-H比独立存在的
分子中键角略大,其原因是。
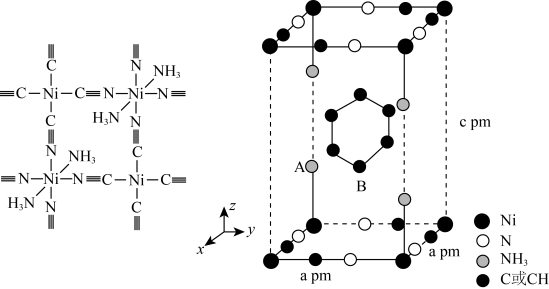
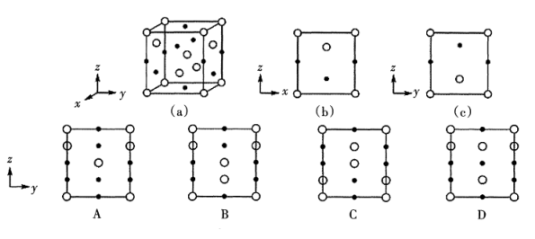
则该晶体的化学式为;A点的分数坐标为;晶胞中A、B间距离d=pm。
 B .
B .  C .
C .  D .
D . 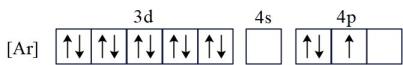
①的空间构型为 ,EDTA中碳原子杂化方式为 。
②C、N、O、S四种元素中,第一电离能最大的是。
③在[Cu(NH3)4(H2O)₂]SO4化合物中,阳离子呈轴向狭长的八面体结构 (如图),该阳离子中存在的化学键类型,该化合物加热时首先失去的组分是。

有机物 | 甲醇 | 甲硫醇(CH3SH) | 甲硒醇 |
沸点/℃ | 64.7 | 5.95 | 25.05 |
