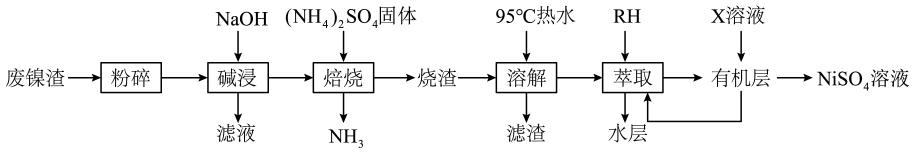
回答下列问题:
萃取率/% | 0.1 | 0.15 | 0.2 | 0.25 | 0.3 | 0.35 | 0.4 |
Ni2+ | 55% | 68% | 80% | 99% | 99.5% | 99.8% | 99.9% |
Fe2+ | 2% | 2% | 4% | 5% | 8% | 30% | 58% |
②物质X的化学式为。


144.5g二丁二酮肟合镍分子内含有σ键mol,碳碳键是由轨道重叠形成的。
a. sp3和sp2 b. sp2和 sp2 c. sp2和p d. sp3和p

反应一段时间后,生成大量气体,悬浊液蓝色褪去,且有红色沉淀生成。
仪器a的名称是,该反应需控制温度为65℃,宜采用的加热方式为(填标号)。
A.酒精灯加热 B.砂浴 C.油浴 D.水浴
气体产物 | H2、CO、CO2 |
溶液中产物 | HCOO-、 |
固体产物 | Cu、Cu2O |
为确定气体成分,下列实验装置的连接顺序是 ( 按气流方向填大写字母)。(已知: CO与银氨溶液能发生氧化还原反应)

实验发现,装置C、D中均未观察到明显现象, E中固体变为红色,A中固体颜色变蓝,则证明生成的气体是。

已知: Cu2O 能与氨水反应生成(无色),
易被氧化生成
。
①由实验现象可知,液体产物中存在离子是 (填离子符号)。
②滤渣1中加入足量浓氨水时,主要反应的离子方程式为。
③滤液2在空气中放置一段时间后,显蓝色的离子是(填离子符号),该离子的空间构型是。
④通过定量测定发现,固体产物主要是铜。综合以上分析,若主要还原产物的物质的量相等,甲醛与新制氢氧化铜发生的主要反应的化学方程式是。
i.2C3H6(g)+O2(g) = 2 ![]() (g) ΔH1 = - 2263.6kJ·mol-1
(g) ΔH1 = - 2263.6kJ·mol-1
ii.H2(g)+ O2(g) = H2O(g) ΔH2 = -241.8 kJ·mol-1
则 ΔH= kJ·mol-1。
A.压强不再变化
B.密度不再变化
C.v正(丙烯): v正(环氧丙烷)=1:1
D.平均相对分子质量不再变化
②为增大C3H6的平衡转化率,可选择的条件是 (填标号)。
A.低温高压 B.增大C3H6浓度
C.使用高效催化剂 D.分离出产物
C3H6(g) + H2(g) + O2(g) = CH3CH2CHO(g) + H2O(g)
C3H6(g) + O2(g) = CH2=CHCHO(g) + H2O(g)
为探究TS-1的粒径对Au/TS-1催化活性的影响,恒温200℃、恒压p kPa条件下,C3H6与H2、O2各20.0 mmol通入反应装置中,t min后部分组分的物质的量如下表所示:
粒径大小/nm | 240 | 450 | 810 | 1130 | |
物质的量 | PO | 1.80 | 1.45 | 1.09 | 0.672 |
/mmol | 所有C3副产物 | 0.20 | 0.32 | 0.05 | 0.092 |
当粒径为240 nm, t min时反应恰好达到平衡状态,则C3H6的总转化率为,若H2的总转化率为α,则环氧化反应的平衡常数Kp为 kPa-1。随着TS-1粒径的增大, PO生成的速率逐渐 (填 “增大”或“减小”),原因是。

已知Ficher吲哚反应:
回答下列问题:
a.苯环上含4个取代基
b.水解产物遇FeCl3溶液显色
 的合成路线。(其它试剂任选)
的合成路线。(其它试剂任选)