|
选项 |
实验操作及现象 |
结论 |
|
|
常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 |
稀硝酸的氧化性比浓硝酸强 |
|
|
取一定量 |
此样品中含有 |
|
|
将银和 |
|
|
|
向溴水中加入苯,振荡后静置,水层颜色变浅 |
溴与苯发生了加成反应 |
| 气体 | 方法 | |
| A | 氨气 | 加热氯化铵固体 |
| B | 二氧化氮 | 将铝片加到冷浓硝酸中 |
| C | 硫化氢 | 向硫化钠固体滴加浓硫酸 |
| D | 氧气 | 加热氯酸钾和二氧化锰的混合物 |
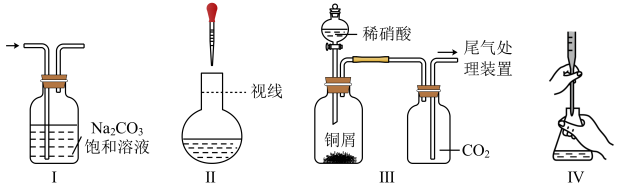
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 用铁槽盛放浓 | 铁不与浓 |
B | 用氢氟酸刻蚀玻璃 |
|
C | 用钾盐作紫色烟花原料 | 电子跃迁到激发态释放能量,产生紫色光 |
D |
| 金属性: |
选项 | 实验操作和现象 | 解释或结论 |
A | 工业上用SiO2与焦炭在高温条件制备粗硅,生成气体CO,得到黑色固体粗硅 | 非金属性:C>Si |
B | 将一块用砂纸打磨过的铝条放入试管,再加入98%浓硫酸3mL,铝条表面无明显现象 | 铝与浓硫酸常温下不反应 |
C | 将稀硝酸加入过量铁粉中,充分反应后再滴加KSCN溶液:有气体生成,溶液不呈血红色 | 稀硝酸只能将Fe氧化为Fe2+ |
D | 往烧杯中加入约20g研细的Ba(OH)2·8H2O晶体和10gNH4Cl晶体,并将烧杯放在滴有水的玻璃片上,用玻璃棒迅速搅拌;有刺激性气味气体生成,烧杯底部结冰,与玻璃片粘在一起 | 吸热反应不一定要加热才能进行 |
选项 | 用途 | 化学原理 |
A | 用氢氟酸雕刻玻璃 | 氢氟酸显弱酸性 |
B | 用FeCl3溶液蚀刻印刷电路板 | FeCl3溶液显酸性 |
C | 用SiO2制造坩埚 | SiO2熔点高 |
D | 用HNO3制备硝酸铵 | HNO3具有强氧化性 |
选项 | 试剂 | 制备的气体 |
A | 氯酸钾、浓盐酸 | Cl2 |
B | 铜、浓硫酸 | SO2 |
C | 浓硫酸、硫化亚铁 | H2S |
D | 稀硝酸、锌 | H2 |

①D溶液中滴加KSCN溶液显红色,写出B→D的离子方程式。
②若F是正盐,其水溶液呈碱性,D是一种温室气体,写出E的一条用途。
【提出猜想】
猜想a:Cu(NO3)2浓度大
猜想b:NO2溶解在Cu(NO3)2溶液中
【实验验证】
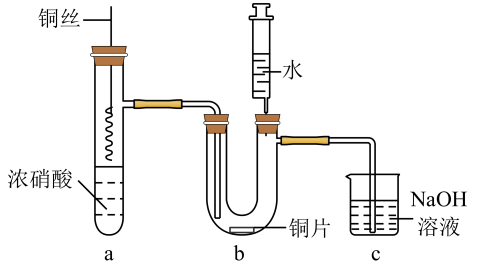
实验i:配制饱和Cu(NO3)2溶液,溶液呈色,证明猜想a不成立。
实验ii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到,5min后,溶液完全变为蓝色,证明猜想b成立。

①由此该组同学认为通过实验说明猜想b成立不严谨,理由是。
②写出NO2与水反应生成HNO2的化学方程式。
③该组同学改进后设计了新的实验:
实验iii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。对比实验ii与实验iii,可推测Cu(NO3)2溶液为绿色的原因主要是。