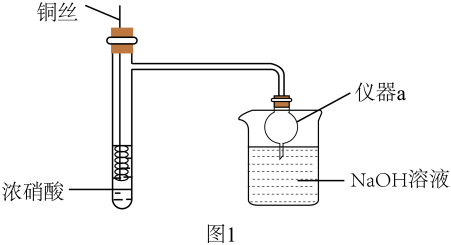
回答下列问题:
【提出猜想】
猜想a:Cu(NO3)2浓度大
猜想b:NO2溶解在Cu(NO3)2溶液中
【实验验证】
实验i:配制饱和Cu(NO3)2溶液,溶液呈色,证明猜想a不成立。
实验ii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到,5min后,溶液完全变为蓝色,证明猜想b成立。

①由此该组同学认为通过实验说明猜想b成立不严谨,理由是。
②写出NO2与水反应生成HNO2的化学方程式。
③该组同学改进后设计了新的实验:
实验iii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。对比实验ii与实验iii,可推测Cu(NO3)2溶液为绿色的原因主要是。
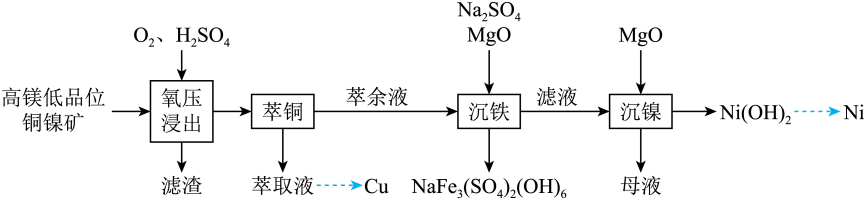
回答下列问题:
该过程主要涉及以下反应:
反应I
反应II
回答下列问题:
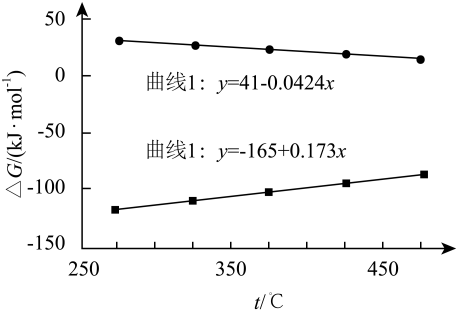

①在工业上,常选用作为合成温度,原因是。
②时
对甲烷的选择性=(保留2位有效数字,已知:选择性=生成
的物质的量/参与反应的
的物质的量),该温度下反应II的
。(保留2位有效数字,已知:分压=组分物质的量分数×总压)