实验1 | 实验2 | 实验3 |
|
|
|
镁条表面有微小气泡,且溶液较长时间无明显变化 | 镁条表面有较多气泡且产生气泡速率逐渐加快,溶液中无明显现象 | 镁条表面有大量气泡,溶液逐渐变浑浊 |
A.sp B. C.
D.
②电子亲和能反映的是元素的气态原子结合电子的难易程度。N、Cl的第一电子亲和能:NCl(填“>”或“<”)。

①该钛硅碳新型材料的化学式为。
②已知该新型材料的摩尔质量为 , 密度为
, 阿伏加德罗常数的值用
表示,则c的长度为nm(用含a、b、
的计算式表示)。

已知:1:①"酸浸”时,和
先与稀硫酸反应分别生成
和
;
②有机萃取剂萃取的能力比萃取
的能力强;
③微溶于冷水、易溶于热水、难溶于乙醇;
④溶液中与
可相互转化:
。
回答下列问题:
①“反萃取”操作加入的试剂是(填化学式)。
②假设“滤液2”中 , “萃取”和“反萃取”每进行一次,
萃取率为90%,5次操作后,“滤液2”中残留的
【萃取率=
】。
②实验发现,温度超过以后沉钒率下降,可能的原因是。

已知:是难溶于水的白色固体;
②为浅黄色固体,不溶于冷水,在空气或热水中逐渐分解;
回答下列问题:
检查装置气密性并加入试剂,装置丙中盛放固体与
溶液的混合物,打开
, 向X中滴加浓盐酸。仪器X的名称为,丙中发生反应的离子方程式为。
反应结束后,为从丙中获取粗产品,请从下列选项中选出最合理的操作(填标号)。
a.在冰水中冷却;b.用普通漏斗过滤;c.用布氏漏斗抽滤;d.冷水洗涤;e.热水洗涤;f.自然晾干;g.在干燥器中干燥
往待检液中加入铋酸钠晶体,加硫酸酸化,生成 , 且溶液变为紫红色,证明待检液中存在
。产生紫红色现象的离子方程式为。
取上述制得的粗产品mg,加入足量的稀硫酸和
稀溶液使其完全反应,再用
的
标准溶液滴定,滴定终点时消耗
溶液
。该产品的纯度是(用含n、m、V的代数式表示)。
Ⅰ. ![]() (g)
(g)
 (g)+H2O(g) ∆H1>0
(g)+H2O(g) ∆H1>0
Ⅱ.  (g)+NH3(g)
(g)+NH3(g) ![]() (g)+H2O(g)+
(g)+H2O(g)+ ![]() (g) ∆H2>0
(g) ∆H2>0
回答下列问题:
化学键 | ||||||
键能( | 351 | 348 | 615 | 413 | 463 | 745 |
据此计算。
 ×100%)。
×100%)。
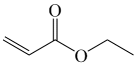
①![]() 的名称为(用系统命名法命名)。
的名称为(用系统命名法命名)。
②随着温度的升高, 的平衡体积分数先增大后减小的原因为。
的平衡体积分数先增大后减小的原因为。
③图中A点对应反应Ⅱ的标准平衡常数(保留两位有效数字)。【其表达式为用相对分压代替浓度平衡常数表达式中的浓度,气体的相对分压等于其分压(单位为
)除以
】
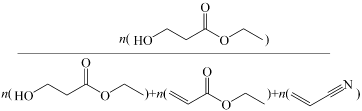
④实际生产中若充入一定量氨气可提高丙烯腈的平衡产率,原因为。
 (g)
(g)

通电过程中,石墨电极2上的电极反应式为。