| 实验序号 | ① | ② | ③ | ④ |
| 加入氯化钠的质量/g | 10 | 15 | 20 | 25 |
| 溶液质量/g | 60 | 65 | 70 | 70 |
| 实验序号 | 水的质量/g | 所加硝酸钾质量/g | 所得溶液质量/g |
| ① | 10 | 2.5 | 12.5 |
| ② | 10 | 3 | 13 |
| ③ | 10 | 3.5 | m |
| ④ | 10 | 4 | 13.2 |
 向硫酸和硫酸铜混合溶液中逐滴加入一定溶质质量分数的氢氧化钠溶液
B .
向硫酸和硫酸铜混合溶液中逐滴加入一定溶质质量分数的氢氧化钠溶液
B .  向一定质量的稀盐酸中逐滴加入等质量、等质量分数的氢氧化钠溶液
C .
向一定质量的稀盐酸中逐滴加入等质量、等质量分数的氢氧化钠溶液
C .  高温煅烧一定质量的石灰石
D .
高温煅烧一定质量的石灰石
D .  向一定量的饱和氢氧化钙溶液中加少量氧化钙
向一定量的饱和氢氧化钙溶液中加少量氧化钙
| 实验序号 | 水的质量(g) | 加入氯化钠的质量(g) | 剩余氯化钠的质量(g) |
| ① | 10 | 2 | 0 |
| ② | 10 | 3 | 0 |
| ③ | 10 | 4 | 0.4 |
| ④ | 10 | 5 | 1.4 |
| 温度℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度(g) | 12.6 | 15.3 | 20.0 | 25.0 | 38.2 |



| 硝酸钾和氯化钾不同温度时的溶解度表 | |||||||||
| 温度/℃ | 0 | T1 | 20 | T2 | 40 | 60 | 80 | 100 | |
| 溶解度/g | 硝酸钾 | 13.3 | 25.0 | 31.6 | 35.1 | 63.9 | 110 | 169 | 246 |
| 氯化钾 | 27.6 | 31.8 | 40.0 | 35.1 | 40.0 | 45.5 | 51.1 | 56.7 | |
下列说法正确的是( )
| 温度/℃ | 10 | 30 | 50 | 70 | 90 |
| 溶解度/100g水 | 27.3 | 39.3 | 49.0 | 54.1 | 51.1 |
氯化钠和硝酸钾在不同温度下的溶解度
|
温度(℃) |
0 |
20 |
40 |
60 |
80 |
100 |
|
氯化钠(克) |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
|
硝酸钾(克) |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |

|
实验序号 |
① |
② |
③ |
④ |
|
加入氯化钠的质量/g |
9 |
36 |
81 |
90 |
|
溶液质量/g |
209 |
236 |
272 |
272 |
若将①中得到的溶液稀释成质量分数为 0.9%的生理盐水,需加水的质量是g. 关于上述实验的叙述正确的是(填序号).
a.①②所得溶液是不饱和溶液
b.③④所得溶液中,溶质的质量分数相等
c.20℃时,将④继续恒温蒸发 100g 水,过滤,得到质量为 36g 的固体
d.20℃时,200g 水中最多溶解氯化钠的质量为 72g.
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度/g |
27.6 |
31.0 |
34.0 |
37.0 |
x |
42.6 |
45.5 |
小明为测定x的值,取4份40℃的水各50g,分别进行实验,并记录数据如下表。
|
实验编号 |
实验1 |
实验2 |
实验3 |
实验4 |
|
氯化钾质量/g |
5 |
15 |
25 |
35 |
|
溶液质量/g |
55 |
65 |
70 |
70 |
请回答下列问题。
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
|
|
溶解度/g |
氯化钠 |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
|
氯化铵 |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
|

A.两种溶液中溶剂的质量相等;
B.两种溶液中溶质质量分数相等;
C.t℃大于20℃。

据此分析,x=,m g 氯化钠不饱和溶液中水的质量为g。
表一 物质的溶解度(20℃)
|
物质 |
NaOH |
Ca(OH)2 |
CaCO3 |
CaSO3 |
|
溶解度(克) |
109 |
0.165 |
0.0014 |
0.0043 |
表二 物质在水中的溶解性等级
|
20℃时的溶解度(克) |
>10 |
1—10 |
0.01—1 |
<0.01 |
|
等级 |
易溶 |
可溶 |
微溶 |
难溶 |
|
温度 |
10 ℃ |
20 ℃ |
30 ℃ |
40 ℃ |
50 ℃ |
60 ℃ |
70 ℃ |
80 ℃ |
|
氯化钠溶解度/g |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
38.4 |
|
硝酸钾溶解度/g |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
169 |

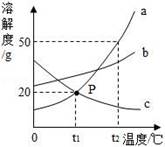
A.①和②的溶液中,溶质质量相等
B.若使③中的固体溶解,可采用加水或升温的方法
C.①、②、③中,只有③中上层清液是饱和溶液
D.①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小
|
实验组别 |
第一组 |
第二组 |
第三组 |
||
|
A |
B |
C |
D |
E |
|
|
实验温度 |
20℃ |
20℃ |
20℃ |
20℃ |
60℃ |
|
溶剂种类 |
水 |
酒精 |
水 |
水 |
水 |
|
溶剂质量 |
20g |
20g |
10g |
10g |
10g |
|
加入固体种类 |
硝酸钾 |
硝酸钾 |
硝酸钾 |
食盐 |
硝酸钾 |
|
加入固体质量 |
10g |
10g |
10g |
10g |
10g |
|
剩余固体质量 |
X |
10g |
7.6g |
6.4g |
0g |
①用电子天平称取10.0g食盐,放入烧杯中;
②量取10.0mL水,倒入上述烧杯中,称量烧杯、食盐和水的总质量为m1g;
③搅拌至食盐不再溶解为止;
④过滤,称量所得食盐溶液和烧杯的总质量为m2g;
⑤计算:m1-m2=g。
|
实验序号 |
海藻酸钠质量/克 |
水的质量/毫升 |
水的温度/℃ |
是否搅拌 |
完全溶解的时间/秒 |
|
1 |
1.4 |
100 |
20 |
否 |
|
|
2 |
1.4 |
100 |
20 |
是 |
|
|
3 |
1.4 |
100 |
30 |
是 |
|
|
4 |
1.4 |
100 |
40 |
是 |
为了探究加入六偏磷酸钠溶液多少对海藻酸钠溶解速度的影响,请参照上表数据设计该实验方案。
完成实验探究:哪些因素影响固体物质在水中的溶解度?
因素1:溶质的种类
在实验中要改变的因素是:溶质的种类
要保持不变的因素是:温度
操作步骤:在常温下,用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入氯化钠、硝酸钾、氢氧化钙各2g,振荡,观察各物质的溶解情况。
实验现象:试管①中有少量氯化钠未溶,试管②中硝酸钾全部溶解,试管③中有多量氢氧化钙未溶。
实验结论:
因素2:温度(以硝酸钾为例)
在实验中要改变的因素是:
要保持不变的因素是:溶质的种类(硝酸钾)
操作步骤:用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入5g硝酸钾晶体,将试管①保持在常温下,将试管②加热并保持在40"C,将试管③加热并保持在60"C,振荡,观察各试管中硝酸钾的溶解情况。
实验现象:试管①中有多量硝酸钾未溶,试管②中有少量硝酸钾未溶,试管③中硝酸钾全部溶解。
实验结论:在不同温度下,固体物质(硝酸钾)在水里的溶解度(填“相等”或“不相等”)。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
硝酸钾 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 |
氯化钠 | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 |
温度/℃ | 60 | 70 | 80 | 90 | 100 | |
硝酸钾 | 110 | 138 | 169 | 202 | 246 | |
氯化钠 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
Ⅰ.剩余溶液一定是硝酸钾饱和溶液
Ⅱ.剩余溶液一定是氯化钠不饱和溶液
Ⅲ.上述方法可以将两者完全分离
Ⅳ.析出的晶体中只含有硝酸钾
硫酸铵和氯化钾是化工生产的副产品,直接作为肥料使用会使土壤酸化或影响作物的生长,工业上往往将氯化钾转化为无氯钾肥.如图1是硫酸铵等几种盐的溶解度曲线.回答下列问题:

① ;②温度相同时, .
③根据溶解度曲线判断产品(无氯钾肥)的化学式是 ;
④操作Ⅰ主要是趁热过滤,过滤后的产品中 (NH4)2SO4晶体析出(填“有”或“没有”).
资料:苯酸钾熔点122.4℃;纯净固体一般都有固定熔点;在常温时苯酸钾溶解度很小.小于0.4g.
【提出问题】分离氯化钾后的白色固体A的成分是什么?
【猜 想】猜想1:苯酸钾;猜想2:氯化钾,猜想3: .
【实验探究】限选试剂:蒸馏水、AgNO3溶液、稀硝酸.
实验操作 | 实验现象 | 实验结论 |
Ⅰ将白色固体A加入水中,加热、溶解、冷却、过滤. | 得到白色晶体和无色滤液 | |
Ⅱ取无色滤液少许于试管中, |
| 白色固体A中含有KCl |
Ⅲ取白色晶体, | 熔点是 | 结合实验Ⅱ,猜想3成立 |
|
温度( ℃) |
10 |
40 |
65 |
75 |
|
剩余固体(克) |
261 |
175 |
82 |
82 |
硝酸钾的溶解度见下表:
|
温度( ℃) |
10 |
40 |
50 |
55 |
60 |
65 |
75 |
80 |
|
溶解度(克) |
20.9 |
63.9 |
85.5 |
95 |
110 |
126 |
150 |
169 |
求:



| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 溶解度/克 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 | 246 |