

| 物质 | MgO | Mg(OH)2 | MgCO3 | “镁粉” |
| 消耗稀盐酸的质量/克 | 121.8 | m | 58.0 | 61.9 |

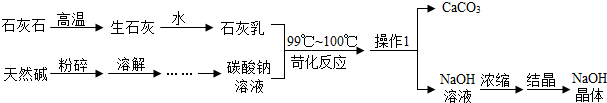
CaCO3=CaO+CO2↑,
CaO+H2O=Ca(OH)2 ,
Ca(OH)2+2HCl=CaCl2+2H2O
CaCO3+2HCl=CaCl2+H2O+CO2↑

请根据有关信息回答问题。
|
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
|
|
加入盐酸的质量/g |
25 |
25 |
25 |
25 |
25 |
25 |
|
锥形瓶中物质的质量/g |
75 |
100 |
a |
150 |
172.8 |
197.8 |


①该反应的基本反应类型为,若生成的水煤气中含氢气是2kg,则含一氧化碳的质量为。
②水煤气在不同催化剂作用下,可以合成不同的物质,如可以合成重要的有机物甲醇(CH3OH)。下列关于甲醇的说法,正确的是。
A.由6个原子构成
B.相对分子质量为32g
C.碳、氢原子个数比为1:4
D.氢、氧元素的质量比为1:4

发现:酒精在常温常压下是一种易燃、易挥发的无色透明液体;具有略带刺激性的特殊香味;能
与水以任意比互溶;可用作燃料和消毒剂。请回答下列问题:

①是一种无色液体,密度比水小;②能和四氧化二氮反应,两者接触即自动起火;③沸点为63℃;④易溶于水。
子是。

①当加入的硝酸钡溶液的质量为克时,沉淀刚好不再产生。
②计算废水中该酸的质量分数。

①KCl ②NaNO3 ③KNO3
产品外包装说明。
完全反应后生成沉淀质量2.33克(杂质不与氯化钡反应),试计算这袋钾肥中硫酸钾的质量,并判断是否符合产品外包装说明。
|
实验次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
|
稀硫酸的用量/克 |
25 |
25 |
25 |
25 |
25 |
25 |
|
剩余固体的质量/克 |
75 |
100 |
125 |
150 |
172.8 |
197.8 |


|
烧杯① |
烧杯② |
烧杯③ |
烧杯④ |
烧杯⑤ |
|
|
加入样品的质量/g |
10 |
10 |
10 |
10 |
10 |
|
加入稀盐酸的质量/g |
10 |
20 |
30 |
40 |
50 |
|
充分反应后生成气体的质量/g |
0.88 |
1.76 |
2.64 |
3.08 |
3.08 |

| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
| 烧杯中剩余物质的质量/g | 118.2 | 136.4 | 155.6 | 175.6 |



|
m1 |
m2 |
m3 |
m4 |
m5 |
|
7克 |
10克 |
15克 |
20克 |
25克 |


![]()

|
实验次数 |
1 |
2 |
3 |
4 |
|
加入稀盐酸的质量/克 |
20 |
20 |
20 |
20 |
|
剩余固体的质量/克 |
6.0 |
4.0 |
M |
1.2 |
①表中M的值为克。
②该石灰石中碳酸钙的纯度为。

①乙试管中的白色沉淀是。
②甲试管中滴加足量 BaCl2溶液目的是 。
如图戊,准确称取11.95g变质的NaOH样品放入锥形瓶中,用电子秤称得锥形瓶及样品的总质量为46.95g,再把150.00g7.3%稀盐酸平均分成5等份,每份30.00g依次加入锥形瓶中,充分反应后用电子秤称得锥形瓶及所盛物质的总质量,实验数据记录如下:
|
加入盐酸的次数 |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
锥形瓶及所盛物质总质量/g |
76.95 |
106.95 |
136.73 |
164.09 |
193.65 |
根据上述实验数据,计算样品中氢氧化钠的质量。

|
加入NaOH溶液的质量/克 |
40.0 |
80.0 |
120.0 |
160.0 |
200.0 |
|
生成沉淀的质量/克 |
0.0 |
2.45 |
7.35 |
9.8 |
9.8 |