| 容器 编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )
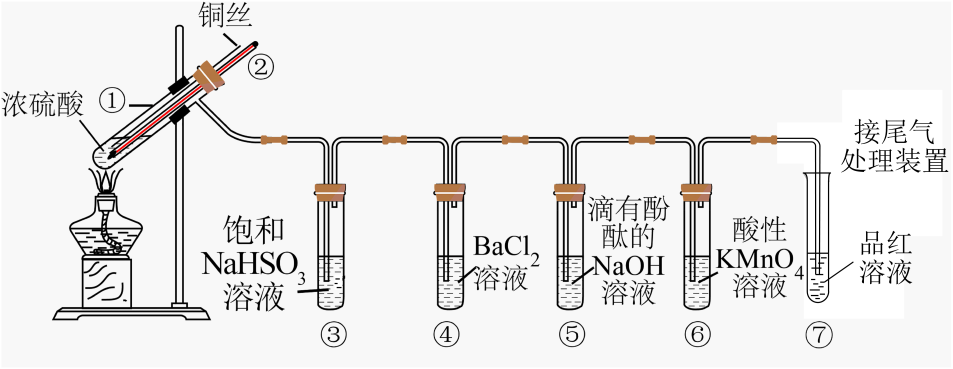
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物CuSO4 , 可立刻向试管①中加水,观察颜色
a.HCl b.Fe2O3 c.KNO3
|
实验序号 |
实验温度 |
有关物质 |
溶液颜色褪至无色所需时间/s |
||||
|
和酸性 |
|
|
|||||
|
V/mL |
c/ |
V/mL |
c/ |
V/mL |
|||
|
A |
293 |
2 |
0.02 |
4 |
0.1 |
0 |
|
|
B |
|
2 |
0.02 |
3 |
0.1 |
|
8 |
|
C |
313 |
2 |
0.02 |
|
0.1 |
1 |
|

定性分析:某同学通过观察甲中两支试管产生气泡的快慢,由此得出和
对
分解的催化效果,该结论填(“合理”或“不合理”),原因。

途径I:C(s)+O2(g)=CO2(g) △H1<0
途径II:先制成水煤气C(s)+H2O(g)=CO(g)+H2(g) △H2>0
再燃烧水煤气:
2CO(g)+O2(g)=2CO2(g) △H3<0
2H2(g)+O2(g)=2H2O(g) △H4<0
则途径I放出的热量(填“大于”“等于”或“小于”)途径II放出的热量;△H1、△H2、△H3、△H4的数学关系式是。
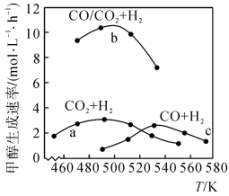
①已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)=CH3OH(g) △H,表中所列为常见化学键的键能数据:
化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
键能/kJ•mol-1 | 348 | 414 | 436 | 326.8 | 1032 | 464 |
则该反应的△H=kJ•mol-1。
②甲醇(CH3OH)也可由天然气来合成,已知:①2CH4(g)+O2(g)=2CO(g)+4H2(l) △H=-71kJ•mol-1 , ②CO(g)+2H2(g)=CH3OH(l) △H=-90.5kJ•mol-1 , ③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ•mol-1 , 则甲醇的燃烧热为。若CO的燃烧热为282.5kJ•mol-1 , 则H2的燃烧热为。
已知:C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566kJ•mol-1
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ•mol-1
则TiO2(s)+2C(s)+2Cl2(g)=TiCl4(s)+2CO(g)的△H=。
I.CO(g)+2H2(g)=CH3OH(g) △H1=-129.0kJ•mol-1
II.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41kJ•mol-1
III.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3
回答下列问题:
H3=。
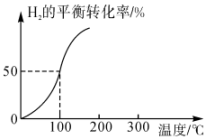
①100℃时反应II达到平衡所需的时间为5min,则反应从起始至5min内,用H2表示该反应的平均反应速率为。
②100℃时,反应II的平衡常数K=。
③其他条件不变时,下列措施可以提高反应II的化学反应速率的是(填标号)。
A.恒容条件下通入He B.增大容器体积
C.升高温度 D.通入更多的H2(g)
④已知:反应II的瞬时速率表达式为v正=k正c(CO2)•c(H2),v逆=k逆c(CO)•c(H2O)(k为速率常数,只与温度有关)。温度由100℃升高到300℃,活化分子百分数(填“增大”“减小”或“不变”)。300℃时,(填“大于”“小于”或“等于”)K(100℃)。