 B .
B .  C .
C .  D .
D . 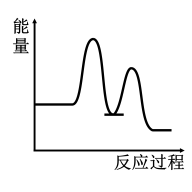
目的 | 方案设计 | 现象和结论 | |
A | 验证NaCl、Na2SO4、NaOH混合溶液中的Cl- | 取混合溶液于试管中,加入过量的Ba(NO3)2溶液充分反应,静置,向上清液中滴加AgNO3溶液 | 若上清液变浑浊。则混合溶液中含有Cl- |
B | 证明氧化性:Cl2>Fe3+> | 向2支盛有FeCl2溶液的试管中分别加入氯水。向其中一支滴加KSCN溶液,向另一支依次滴加H2SO3溶液相BaCl2溶液 | 第一支试管中溶液变成血红色, 第二支试管中产生白色沉淀,则证明氧化性:Cl2>Fe3+> |
C | 证明CH4和Cl2光照下发生取代反应 | 将装有干燥Cl2的集气瓶倒扣在装有干燥CH4的集气瓶上,抽出玻璃片,置于光照条件下反应 | 观察到集气瓶内出现白雾,则证明CH4与Cl2发生了取代反应 |
D | 探究AgCl和AgI的溶解度的大小 | 向2支盛有2mL相同浓度硝酸银溶液的试管中分别加入相同滴数同浓度的NaCl和NaI溶液 | 若一支试管中无明显现象,另一支试管中产生黄色沉淀,则AgCl溶解度大于AgI |

X | 该元素的一种核素的中子数为0 |
Y | 能与X形成正四面体形的分子 |
Z | 空气中含量最多的元素 |
W | 其单质通常作助燃剂 |
U | 地壳中含量最多的金属元素 |
V | M层电子数是K层的3倍 |
①0.1 mol·L-1 NH4Cl ②0.1 mol·L-1 CH3COONH4 ③0.1 mol·L-1 NH4HSO4 ④1 L含0.1 mol NH3·H2O和0.1mol NH4Cl混合液 ⑤0.1 mol·L-1 NH3·H2O
请根据要求填写下列空白:
ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2
ⅲ.CH3OH(g)⇌CO(g)+2H2(g) ΔH3
回答下列问题:
化学键 | H—H | C=O | C≡O | H—O |
E/kJ·mol-1 | 436 | 803 | 1 076 | 465 |
由此计算ΔH2=kJ·mol-1。已知ΔH3=99 kJ·mol-1 , 则ΔH1= kJ·mol-1。

①温度为470 K时,图中P点(填“是”或“不是”)处于平衡状态。在490 K之前,甲醇产率随着温度升高而增大的原因是;490 K之后,甲醇产率下降的原因是。
②一定能提高甲醇产率的措施是 (填字母)。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
①某实验小组用100mL 0.50 mol∙L−1 NaOH溶液与60mL 0.50 mol∙L−1硫酸进行中和热的测定。装置如图所示,回答下列问题:

图中装置缺少的仪器是。
②请根据下表中的数据计算实验中和热,近似认为0.50 mol∙L−1 NaOH溶液与0.50 mol∙L−1硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容为c=4.18J/(g∙℃)则上述实验中和热ΔH= (取小数点后一位)
附:中和热的计算公式:ΔH= −kJ·mol-1
实验 次数 | 起始温度T1/℃ | 终止温度 T2/℃ | ||
HCl | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.4 | 26.2 | 26.3 | 30.4 |
③上述实验结果与中和热ΔH= −57.3 kJ∙mol−1有偏差,产生偏差的原因可能是
A.量取NaOH溶液时俯视读数 B.为了使反应充分,可以向酸中分次加入碱
C.实验装置保温隔热效果差 D.用铜丝代替玻璃棒搅拌

①根据滴定曲线,V(NaOH)=30.00mL时,pH=。(溶液体积变化忽略不计)
②下列关于滴定分析,正确的是。
A.滴定前,锥形瓶和滴定管均须用标准溶液润洗
B.根据滴定曲线可知,选择甲基红指示反应终点,误差比甲基橙的小
C.当25mL滴定管的液面位于0刻度时,滴定管中的液体体积刚为25.00mL
D.滴定时,通常用左手挤压玻璃珠稍上处,右手摇动锥形瓶,使溶液向同一方向旋转
③滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→→→→→记录起始数据→开始滴定。
A.调整滴定液液面至零刻度或零刻度以下
B.装入滴定液至零刻度以上
C.烘干
D.用洗耳球吹出润洗液
E.用滴定液润洗2至3次
F.排除气泡
④若开始滴定前,滴定管尖悬挂的液滴未擦去,则测定的结果 (填“偏大”、“偏小”或“无影响”)。若滴定结束时仰视读数,则测定的结果 (填“偏大”、“偏小”或“无影响”)。