一、选择题(本题共15小题,第1~10小题,每小题4分,第11~15小题,每小题3分,共55分。请选出每小题其中一个符合题意的选项,不选、错选均不给分)
-
1.
某同学用pH计测得生活中一些物质的pH,其数据如下表。下列说法正确的是( )
| 物质 | 肥皂水 | 牙膏 | 西瓜汁 | 苹果汁 |
| pH | 10.2 | 8.5 | 5.8 | 2.9 |
A . 牙膏显酸性
B . 西瓜汁的酸性比苹果汁的酸性强
C . 肥皂水不能使无色酚酞试液变色
D . 被蚊虫叮咬(含有蚁酸)可涂抹牙膏或肥皂水
-
2.
下列各物质的俗称和化学式表示的是同一种物质的是( )
A . 消石灰 CaO
B . 纯碱 NaOH
C . 石灰石 CaCO3
D . 生石灰 Ca(OH)2
-
3.
(2020·湖州)
下图是一定量的B
2和AB在一定条件下混合以及混合结果的模型,则( )

A . 反应得到的生成物有两种
B . 反应前后元素化合价不变
C . 参加反应的两种分子个数比为3:2
D . 该反应为化合反应
-
-
5.
下列关于科学实验中的描述正确的是( )
A . 在某固体物质中加入稀盐酸,产生大量气泡,该物质一定是碳酸盐
B . 在某溶液中加入氯化钡溶液和足量稀硝酸,产生白色沉淀,该溶液中一定含有硫酸根离子
C . 在某溶液中加入硝酸银溶液和足量稀硝酸,产生白色沉淀,该溶液中一定含有氯离子
D . 在稀盐酸与氢氧化钠反应后的溶液中滴加无色酚酞试液不变色,则两者恰好完全反应
-
6.
要使如图所示装置中的气球明显鼓起来,则使用的固体和液体可以是( )
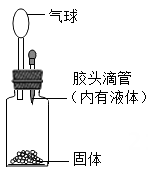
①锌和稀硫酸 ②石灰石和稀盐酸
③氧化铁和稀硫酸 ④氢氧化钠和水
A . ①
B . ①②③
C . ①②④
D . ①②③④
-
7.
如图是稀盐酸和NaOH溶液反应的pH变化曲线图,下列据图分析得出的结论正确的是( )

A . 该反应是将NaOH溶液滴入稀盐酸中
B . B点 时 加入无色酚酞溶液,溶液显红色
C . A点时,溶液的溶质为NaOH、NaCl
D . B点时加入的溶液的质量和另一种溶液的质量一定相同
-
8.
在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表所示。关于此反应,下列认识不正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 1 | 20 | 15 | 2 |
| 反应后质量/g | m | 29 | 0 | 8 |
A . m 的值是 1
B . 甲可能是该反应的催化剂
C . 该反应是分解反应
D . 参加反应的乙、丁的质量比是 29:8
-
9.
通过物质间相互反应可以实现物质间的相互转化,下列物质间的转化,通过一步化学反应不能实现的是( )
A . CaO→Ca(OH)2→CaCO3
B . Mg→MgO→MgCl2
C . CuO→Cu(OH)2→CuCl2
D . NaOH→NaCl→NaNO3
-
10.
下列各组离子能在指定液体中大量共存的一组是( )
A . 在稀盐酸中: Ca2+、CO32-、K+
B . 在氢氧化钠溶液中:K+、Ba2+、Cl-
C . 在氯化钠溶液中:H+、Ag+、NO3-
D . 在硫酸铜溶液中:Ba2+、Na+、OH-
-
11.
提纯是科学实验中常用的一种方法。 除去下表中混合物中的杂质,所选除杂试剂正确的是( )
| 选项 | 混合物(括号内为杂质) | 除杂试剂 |
| A | NaOH溶液(Na2CO3) | 适量的稀盐酸 |
| B | CaO粉末(CaCO3) | 适量的稀盐酸 |
| C | CO2(H2O ) | 足量的氢氧化钠固体 |
| D | CuSO4溶液(H2SO4) | 足量的氧化铜粉末 |
A . A
B . B
C . C
D . D
-
12.
(2017九上·湖州月考)
现有① NaOH溶液、② KCl溶液、③ MgCl
2溶液、④ CuSO
4溶液,不用其他试剂,可通 过实验方法将它们一一鉴别开来,鉴别出来的先后顺序可能是( )
A . ①②③④
B . ①④③②
C . ④③②①
D . ④①③②
-
13.
向AgNO3和Cu(NO3)2的混合溶液中加入一定量锌粉,充分反应后过滤,得到滤渣和蓝色滤液。关于该滤渣和滤液说法正确的是( )
A . 向滤渣中加入稀盐酸,可能有气泡产生
B . 滤液中一定有Cu(NO3)2和Zn(NO3)2
C . 滤渣中一定有Ag,可能有Cu和Zn
D . 滤液中一定无AgNO3 , 可能有Zn(NO3)2
-
14.
某溶液中的溶质有NaOH、HCl、H
2SO
4和MgCl
2中的一种或几种,向该溶液中滴加Ba(OH)
2溶液,产生沉淀的质量与加入Ba(OH)
2溶液质量的关系如图所示,下列说法正确的是( )

A . HCl和H2SO4一定存在
B . NaOH、H2SO4和MgCl2一定不存在
C . HCl和MgCl2一定存在
D . HCl一定存在NaOH、H2SO4一定不存在,MgCl2可能存在
-
二、填空题(本大题共6小题,每空2分,共34分)
-
16.
人类的生活和生产都离不开金属。铝、铁、铜是人类广泛使用的三种金属,与我们的生活息息相关。
-
-
(2)
铁制品锈蚀的过程,实际上是铁丝与空气中的和水蒸气发生了化学反应。
-
(3)
下列方法中不能防止铁制品腐蚀的是
A . 表层镀锌
B . 用食盐水浸泡
C . 表层涂漆
D . 表层涂油
-
17.
不用烧,不用煮,加入凉水就能享用热气腾腾美食的自热火锅,深受消费者的喜爱
查阅包装上的说明发现发热包中物质的主要成分是生石灰、碳酸钠、铝等。
-
(1)
生石灰遇水会放出大量的热,请写出它的化学方程式。
-
(2)
自热火锅使用后,产生的垃圾应该进行分类,使用过的发热包,应该投入下图中的
(填选项字母)

-
18.
有些酸随着浓度的改变会表现出不同的化学性质。请回答下列问题:
-
(1)
用毛笔蘸取稀硫酸在竹片上画花,然后把竹片放在小火上烘干,再用水洗净,在竹片上就得到一幅精美的呈黑色或褐色的竹片画。在烘干的过程中稀硫酸变为浓硫酸,在制作竹片画的过程中利用了浓硫酸的性;
-
(2)
在加热的条件下浓硫酸与铜反应的化学方程式是Cu+2H
2SO
4(浓)

CuSO
4 +SO
2↑+2X,则的化学式是
。但过量的铜和浓硫酸充分反应后溶液中仍有少量硫酸剩余,其原因是
-
19.
现有一包固体粉末,可能由CaCO3、Na2CO3、Na2SO4、CuSO4、NaCl中的一种或几种组成,为了确定其成分,取适量试样进行下列实验。请根据实验现象判断:
-
(1)
取试样溶于水,得到无色澄清溶液,则此固体粉末中一定没有
-
(2)
取上述溶液适量,滴加过量的BaCl2溶液,出现白色沉淀,再加入过量的稀硝酸,沉淀 部分消失并产生气泡,则此固体粉末中一定有。
-
(3)
取(2)中实验后的上层清液,加入稀硝酸、硝酸银溶液,出现白色沉淀,由此该同学得出此固体粉末中一定含有NaCl,你认为此结论是否正确?(填“是”或“否”)。
-
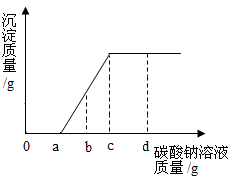
20.
现有盐酸和氯化钡的混合溶液,向其中逐滴滴入碳酸钠溶液,生成沉淀质量与滴入碳酸钠溶液质量的变化关系如图所示。 0-a段无沉淀产生,请用化学反应方程式解释原因
。当碳酸钠溶液滴至c克时溶液中溶质是
。当加到d点时溶液显
性。
-
21.
如图是铁、盐酸、氢氧化钙、硫酸铜和氯化镁五种物质的反应与转化关系,“﹣”表示两种物质之间能发生化学反应,“→”表示在一定条件下的物质转化。已经C溶液为蓝色。
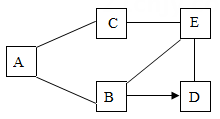
-
-
-
(3)
从物质反应规律分析,在单质、氧化物、酸、碱和盐中,能与 B 反应生成D 的物质有 (填序号)。
A . 2 类
B . 3 类
C . 4类
D . 5 类
三、实验探究题(本题共4小题,每空3分,共36分)
-
22.
小明为探究酸、碱、盐的化学性质,做了如下实验:
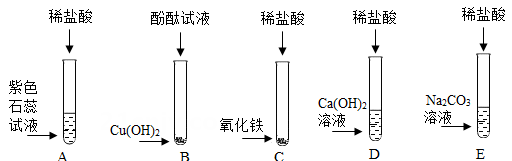
-
-
(2)
反应后试管 C 溶液中一定存在的大量阳离子是;
-
(3)
小明把 D、E 反应后的液体倒入一个洁净的烧杯中,观察到只有白色沉淀生成,过滤后得到白色沉淀和无色滤液,小明分别对试管 D、E 反应时的反应物用量有如下描述,正确的是 。
A . 试管 D中氢氧化钙溶液一定过量
B . 试管 D中稀盐酸可能过量
C . 试管 E中碳酸钠一定过量
D . 试管 E中稀盐酸一定过量
-
23.
实验室可以选用如图所示的装置,制取二氧化碳气体(混有氯化氢、水蒸气)和进行有关实验,回答下列问题。

-
(1)
如果要证明制得的气体中混有氯化氢气体,应把A装置与装置连接,如果把混有氯化氢气体的二氧化碳直接通入C装置,没有看到溶液变浑浊的现象,请用化学方程式解释原因。
-
(2)
如果要收集一瓶纯净、干燥的二氧化碳气体,请从图中各装置中选择适当的装置进行连接,连接顺序是。
-
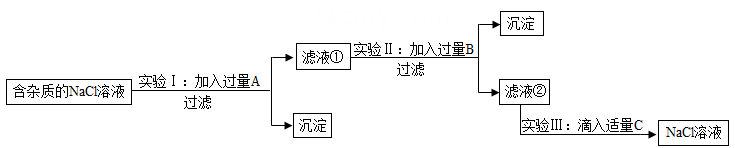
24.
盐化工是我市的一项重点产业,绿色应用是化工生产的发展方向。为了除去NaCl溶液中含有的少量MgCl
2、CaCl
2和Na
2SO
4等杂质,某小组同学选用Na
2CO
3溶液、Ba(OH)
2溶液、稀盐酸三种试剂,按一定的顺序进行如图所示的实验。回答下列问题。
-
(1)
实验Ⅰ中加入试剂A除去的杂质是MgCl2和Na2SO4 , 那试剂A是溶液。
-
(2)
实验Ⅱ中加入试剂B后过滤得到的沉淀是(填化学式)。
-
(3)
滤液②中除NaCl外,还含有的溶质是(填化学式)。
-
25.
工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠。某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究。
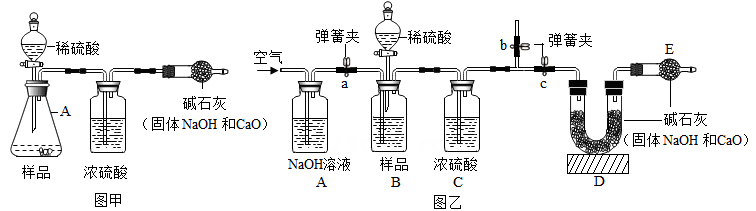
【原理思路】利用碳酸钠与稀硫酸反应产生CO2 , 通过CO2 质量的测定,确定样品中碳酸钠的质量,从而计算烧碱样品纯度。
-
(1)
【交流讨论】小明认为图甲实验方案的设计有缺陷,若按该方案进行测定会导致难以避免的误差。你认为下列哪些因素会导致难以避免的误差
(填序号)。
①加入的稀硫酸量不足 ②装置内空气中的CO2没有排出
③反应产生的CO2未被完全吸收 ④干燥管与空气直接相通
-
(2)
【方案改进】为减少误差,使CO2质量的测定更准确,该小组同学根据以上讨论,对图甲方案进行改进,设计了如图乙的实验方案(固定装置省略)。图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的控制方法是________。(填选项)
A . 打开a,b 关闭c
B . 打开a,c 关闭b
-
(3)
【数据分析】若撤去图乙中的C装置,则测得工业烧碱的纯度将(填“偏高”、“偏低”或“无影响”)。
四、解答题(本题共6小题,第26、27、28小题各6分,第29小题9分,第30小题8分,第31小题10分,共45分)
-
26.
治疗新冠患者用到的中医药“金银花”,成效明显。中医药中“金银花”的有效成分“绿原酸”具有抗菌杀毒的作用,其分子式为C16HXO9。已知绿原酸的相对分子质量为354,请你计算:
-
-
-
(3)
“绿原酸”中氧元素的质量分数是(计算结果精确到0.1%)
-
27.
科学小组学习了有关金属的知识后,做了以下设计和实验。
-
(1)
为了探究铁铜银三种金属的活动顺序,他设计了四个方案,其中你认为不可行的是 ________(填选项字母)。
A . 铁 银 硫酸铜溶液
B . 铁 铜 硝酸银溶液 稀盐酸
C . 铜 氯化亚铁溶液 硝酸银溶液
D . 铜 银 铁 稀盐酸
-
(2)
将铁粉加入盛有硫酸锌和硫酸铜混合溶液的烧杯中,充分反应后过滤,在滤渣中滴入稀盐酸,有气泡产生。据此判断,滤渣中含有,滤液中的溶质是
-
28.
向10g大理石样品(杂质不溶于水,也不与盐酸反应)分两次加入一定溶质质量分数稀盐酸,充分反应后烧杯内物质总质量变化如图所示。

请计算:
-
(1)
第二次加入50g稀盐酸后的溶液中所含的溶质是(填化学式)
-
-
29.
过氧化氢溶液保存时,因缓慢分解导致质量分数变小(化学方程式2H
2O
2=2H
2O+O
2↑)。为探究酸碱性对过氧化氢分解快慢的影响,小科利用图甲装置,每次实验往锥形瓶中加10g30%过氧化氢溶液,再滴加调节剂,使其 pH 分别从 3 依次调至 13,在 60℃反应温度下进行实验,获得数据如图乙。

-
-
(2)
根据本实验结果,对实验室常温保存过氧化氢溶液提出合理的建议: 。
-
(3)
某次实验中,当 10g 溶质质量分数为 30%的过氧化氢溶液放置一段时间后,发现排出水的体积约为224mL,求剩余过氧化氢溶液的溶质质量分数为多少?(氧气的密度为1.429g/L)(写出计算过程,滴加的调节剂对溶液质量的影响忽略不计,计算结果精确到 1%)
-
30.
某校科学兴趣小组同学发现实验室有一份在空气中潮解变质的氢氧化钠样品,欲知其组成成分,现取样品9.8g向其中逐渐加入一定质量分数的稀硫酸,产生气体质量与滴入稀硫酸的质量关系如图所示。试计算:
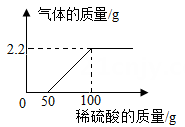
-
-
-
-
31.
某科学兴趣小组的同学要测定铜-锌合金或铜-银合金中铜的质量分数,实验室只提供了一瓶未标明溶质质量分数的稀硫酸和必要的仪器。称取某合金样品20g放入烧杯中,再将80g稀硫酸分四次加入,充分反应,测得实验数据如表所示:
|
测量次数
|
第1次
|
第2次
|
第3次
|
第4次
|
|
加入的稀硫酸质量/g
|
20
|
20
|
20
|
20
|
|
烧杯中剩余物的质量/g
|
39.92
|
59.84
|
79.80
|
99.80
|
-
(1)
你认为能测出其中铜的质量分数的是 合金。(选填:铜-锌 或 铜-银)
-
-
-

