|
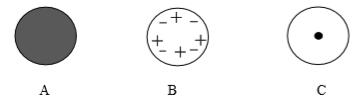
| A原子 | B 原子 | C原子 |
| 质子数 | 8个 | 8个 | 7个 |
| 中子数 | 8个 | 9个 | 7个 |






|
粒子名称 |
质子数 |
中子数 |
电子数 |
|
A |
14 |
14 |
14 |
|
B |
26 |
30 |
24 |
|
C |
14 |
14 |
18 |
|
D |
14 |
18 |
14 |


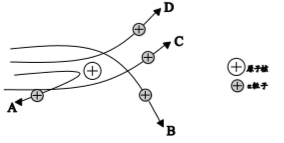
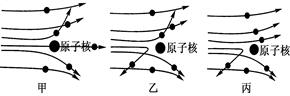
绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
 B .
B .  C .
C . 
【提出问题】电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
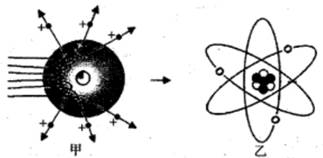
【进行实验】1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。

⑴放射源-放射性物质放出α粒子(带正电荷),质量是电子质量的7000倍;
⑵金箔-作为靶子,厚度1um,重叠了3000层左右的原子;
⑶荧光屏-α粒子打在上面发出闪光;
⑷通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】

1811年,意大利化学家阿伏加德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。
1897年,汤姆森通过实验发现了电子,进一步发展了原子、分子论。汤姆森主要是纠正了“道尔顿原子论”中的观点。
1911年,卢瑟福又通过实验,推测原子是由和核外电子构成,并提出了沿用至今的现代原子结构理论。
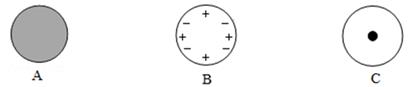
原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了来表达他们的理论成果。
|
粒子名称 |
质子数 |
中子数 |
电子数 |
带电性 |
|
A |
14 |
14 |
14 |
不带电 |
|
B |
26 |
30 |
24 |
带 2 个单位正电荷 |
|
C |
14 |
14 |
16 |
|
|
D |
14 |
16 |
14 |
不带电 |

根据上述实验现象能得出关于金箔中金原子结构的一些结论,试写出其中的三点:
A. ;
B.;
C.。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.玻尔的原子模型的建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
【过程与现象】1911年英国科学家卢瑟福进行了著名的α粒子(带正电)轰击金箔实验。结果发现:绝大多数α粒子穿过金箔后仍沿原方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的几乎达到180°,像是被金箔弹了回来。
【解释与结论】