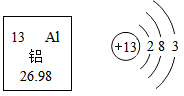
铝的相对原子质量是,铝原子在化学变化中易(选填“得到”或“失去”)电子;铝制品耐腐蚀性强,原因是(用化学方程式表示)。
 已知:金属钒的氧化物能与酸反应;SiO2不溶于水也不溶于初中常见的酸。
已知:金属钒的氧化物能与酸反应;SiO2不溶于水也不溶于初中常见的酸。
回答下列问题:
|
pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
|
钒沉淀率/% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
结合上表,在实际生产中,加入氯化铵调节溶液的最佳pH范围为。
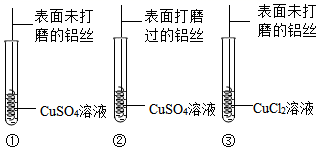
(讨论交流)金属铝在常温下易与空气中的氧气反应生成致密的氧化铝薄膜。实验③中的铝丝表面会析出红色固体,是因为CuCl2溶液中的粒子破坏了铝表面的氧化铝薄膜,是哪种粒子破坏了铝表面的氧化铝薄膜呢?
(猜想与假设)猜想I:H2O;
猜想Ⅱ:Cu2+;
猜想Ⅲ:。
|
序号 |
实验 |
现象 |
推论 |
|
④ |
向试管④中加入水 |
无明显现象 |
H2O不能破坏氧化铝薄膜 |
|
⑤ |
向试管⑤中加入KCl固体 |
铝表面析出红色固体 |
K+或Cl-能破坏氧化铝薄膜 |
|
⑥ |
向试管⑥中加入K2SO4固体 |
|
K+和SO42-都不能破坏氧化铝薄膜 |
(实验结论)猜想Ⅲ正确。
同学们认为实验④没有必要进行,原因是。
通过对比实验(选填“①”“②”或“③”)可得知,打磨能破坏氧化铝薄膜。
将表面未打磨的铝丝浸入稀硫酸中,整个过程中观察到现象是。
相同条件下,稀盐酸与稀硫酸分别与表面未打磨的铝丝反应,反应速率不同的原因是。
(设计实验方案)实验装置如图所示(固定装置已省略):
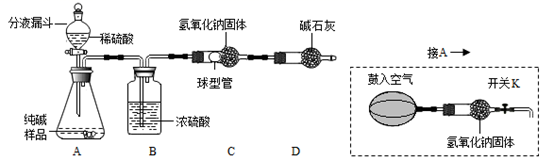
已知:实验室不能用浓硫酸吸收氯化氢气体。需要测定的实验数据:纯碱样品的质量;实验前后C装置(包含氢氧化钠固体)的总质量。
有同学认为用图1所示装置进行实验会造成测得的纯碱纯度偏低,原因是。
①反应前,断开B、C装置之间的连接鼓入空气的作用是。
②反应后,鼓入空气的作用是。