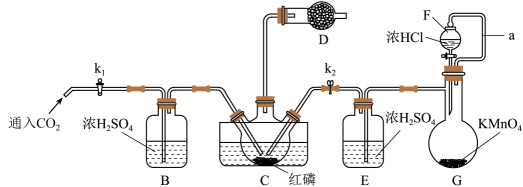
经查阅资料知:红磷与少量Cl2反应生成PCl3 , 与过量Cl2反应生成PCl5 , PCl3遇水会强烈水解生成H3PO3 , PCl3遇O2会生成POCl3 , PCl3、POCl3的熔沸点见如表。
物质 | 熔点/ oC | 沸点/ oC |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
完成下列填空:
第一步:迅速移取20.000 g PCl3粗产品,加水完全水解;
第二步:配成500mL溶液,移取25.00mL溶液置于锥形瓶中;
第三步:加入0. 500mol·L-1碘溶液20.00 mL,碘过量,H3PO3完全反应生成H3PO4 , 反应方程式为H3PO3+H2O+I2=H3PO4+2HI;
第四步:加入几滴淀粉溶液,用1.000 mol·L-1Na2S2O3标准溶液滴定过量的碘,反应方程式为I2+2Na2S2O3=Na2S4O6+2NaI,滴至终点时消耗Na2S2O3标准溶液12.00mL。
第二步需要的定量仪器名称为。根据上述数据,计算该产品中PCl3的质量分数为。