1.
(2021·广东)
我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g)  2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1
b)CO2(g)+H2(g)  CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2
c)CH4(g)  C(s)+2H2(g) ∆H3
C(s)+2H2(g) ∆H3
d)2CO(g)  CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4
e)CO(g)+H2(g)  H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5
-
(1)
根据盖斯定律,反应a的∆H1=(写出一个代数式即可)。
-
-
(2)
上述反应体系在一定条件下建立平衡后,下列说法正确的有_______。
A . 增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B . 移去部分C(s),反应c、d、e的平衡均向右移动
C . 加入反应a的催化剂,可提高CH4的平衡转化率
D . 降低反应温度,反应a~e的正、逆反应速率都减小
-
-
(3)
一定条件下,CH
4分解形成碳的反应历程如图所示。该历程分
步进行,其中,第
步的正反应活化能最大。
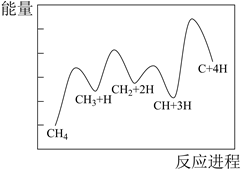
-
-
(4)
设
K 
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以
p0(
p0=100kPa)。反应a、c、e的ln
K 
随

(温度的倒数)的变化如图所示。
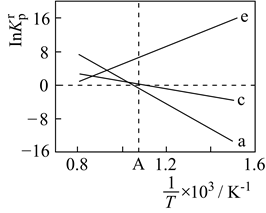
①反应a、c、e中,属于吸热反应的有(填字母)。
②反应c的相对压力平衡常数表达式为K  =。
=。
③在图中A点对应温度下、原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程。
-
-
(5)
CO2用途广泛,写出基于其物理性质的一种用途:。
-
2CO(g)+2H2(g) ∆H1
CO(g)+H2O(g) ∆H2
C(s)+2H2(g) ∆H3
CO2(g)+C(s) ∆H4
H2O(g)+C(s) ∆H5


=。