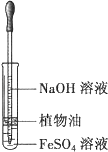
 观察Fe(OH)2的生成
B .
观察Fe(OH)2的生成
B . 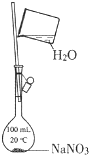 配制一定物质的量浓度的NaNO3溶液
C .
配制一定物质的量浓度的NaNO3溶液
C . 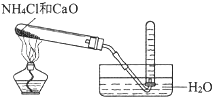 实验室制取氨
D .
实验室制取氨
D . 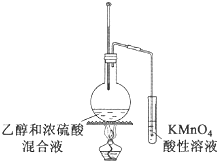 验证乙烯的生成
验证乙烯的生成


①E元素在元素周期表中的位置是.
②由D和F,Y,Z所形成的最简单常见共价型化合物中,还原性最强的是(用化学式表示).
③F,X,Z形成的简单离子半径从大到小顺序为(用离子符号表示).
④X与Z能形成一种离子化合物,用电子式表示其形成过程:.
⑤2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是.
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |