
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
熔点/℃ | 1410 | -70.4 | -126.5 | -122 | -118 | -114.2 | -185 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |

Ⅰ.构成原电池能增大化学反应速率,甲、乙两个原电池装置如图所示:
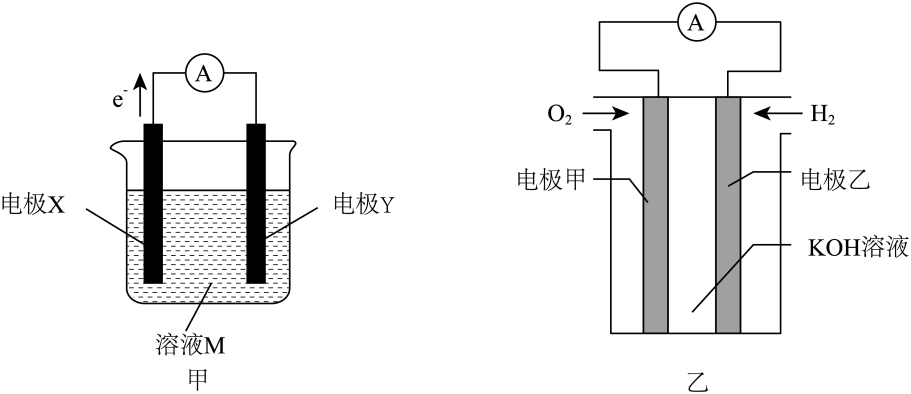
回答下列问题:
①电极X的电极反应式为。
②该电池的正极是(填“镁棒”或“铝棒”),该电极产物W是(填化学式)。
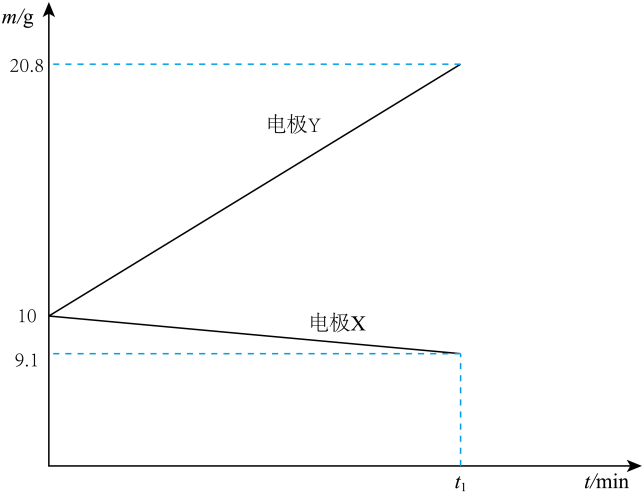
a.Fe电极 b.Mg电极 c.Cu电极 d.Al电极
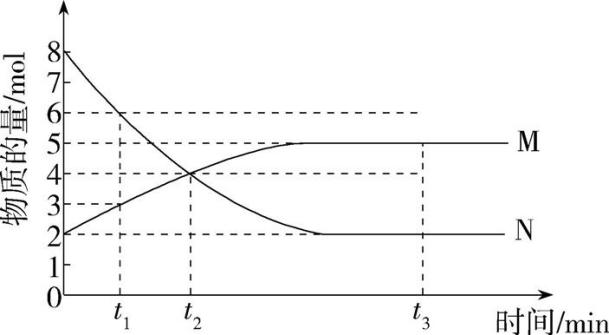
t2 min时,v(正)(填“>”“<”或“=”)v(逆)。