化学式 | |||||
电离常数 |
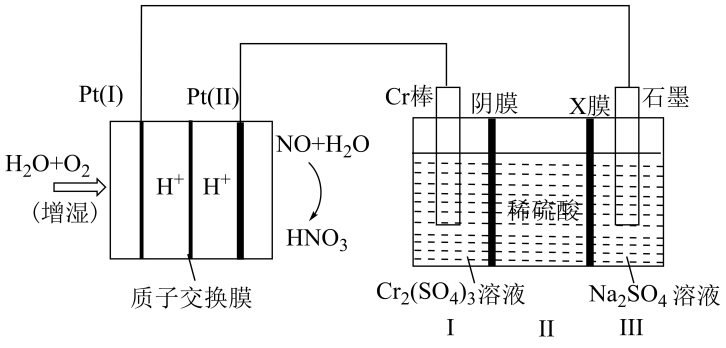
①Pt(Ⅰ)电极上发生的电极反应式为。
②X膜为离子交换膜(填“阴”或“阳”)。
③理论上,若Pt(Ⅱ)电极上参加反应的NO在标况下的体积为4.48L,则Cr棒增重g。
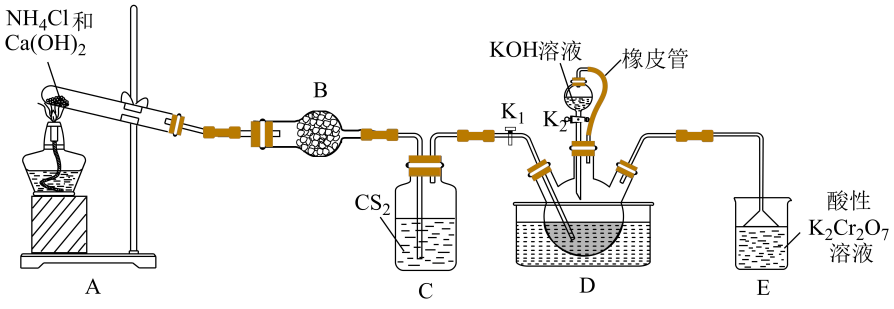
已知:①不溶于
,
密度比水大且不溶于水;
②三颈烧瓶内盛放:、水和催化剂;
③ , 该反应比较缓慢且
在高于170℃易分解。
回答下列问题:
①晶体中KSCN的质量分数为(计算结果保留3位有效数字)。
②滴定前滴定管尖嘴部分有气泡,达到终点后气泡消失,则KSCN的质量分数。(填“偏大”、“偏小”或“无影响”)

已知:常温下,、
,
、
开始沉淀至完全沉淀时的pH分别为2.7~3.7、4.2~5.1、5.4~6.7、6.2~8.0。回答下列问题:
主反应Ⅰ:
副反应Ⅱ:
A.低温、低压 B.低温、高压 C.高温、高压 D.高温、低压

①a点(填“>”、“<”或“=”);
②c点的转化率比b点低的原因是;
③温度为时,将等物质的量的
和
充入体积为1L的密闭容器中,若只发生主反应Ⅰ,该反应的平衡常数K=2.实验测得:
、
,
、
为速率常数。温度为
, 达平衡时:
, 则
(填“>”、“<”或“=”)
。