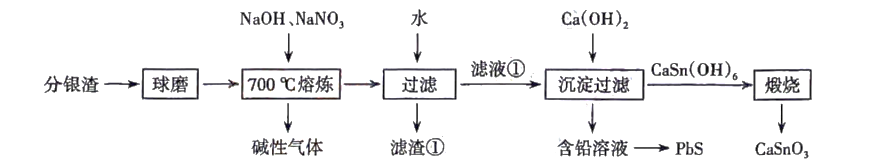
已知:“滤液①”的主要成分有、
.
回答下列问题:

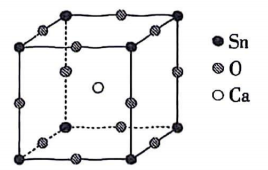
Ⅰ.过碳酸钠的合成
某学习小组用与稳定剂的混合溶液和
化合制备过碳酸钠.称取
配制成饱和溶液后加入三颈烧瓶中,加入稳定剂,搅拌使其溶解.接着加入11mL乙醇搅匀,再加入
溶液搅匀.然后将盛有反应混合物的三颈烧瓶置于冰水浴中,搅拌反应30min,装置如图所示.
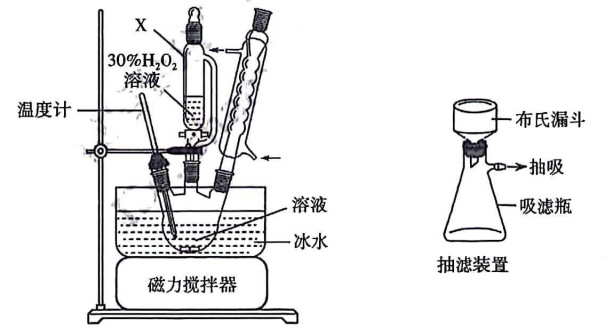
取0.14g过碳酸钠样品和少量二氧化锰倒入气囊Q(Q为弹性良好的气球,气囊内外气压差可忽略,导管内气体体积可忽略不计)中进行测定,装置如下.
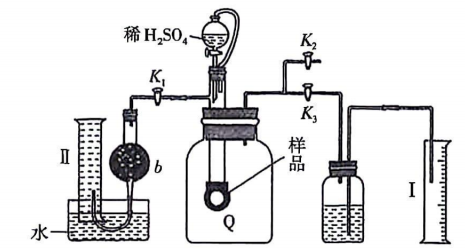
下列分析错误的是____.
在一定压强下,将和
加入1L容积不变的密闭容器中,已知温度对
的平衡转化率、实际转化率和催化剂催化效率的影响如图1所示,结合图像分析该反应实际反应温度定于250℃的原因可能是.

图1
以合成甲醇涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
, 反应Ⅲ能自发进行的条件是(填“高温”或“低温”).
图2 图3
图3
已知:选择性
.
①对于以上制甲醇的过程,以下描述正确的是(填序号).
A.反应中经历了、
键的形成和断裂
B.加压可以提高的平衡转化率
C.升高温度可以提高甲醇在平衡时的选择性
②与
混合气体以不同的流速通过反应器,气体流速与
转化率、
选择性的关系如图3.流速加快可减少产物中
的积累,减少反应(用化学方程式表示)的发生,从而减少催化剂的失活,提高甲醇选择性.