| 选项 | 现象或事实 | 解释 |
| A | 大坝铁闸常连接直流电源的负极 | 利用外接电流的阴极保护法防止铁闸被腐蚀 |
| B | 厨房天然气泄漏有一种特殊的味道 | CH4是无色有刺激性气味的可燃性气体 |
| C | 石墨应用于导电设备 | 在通电作用下,石墨能释放出自由移动的电子 |
| D | 可用铁槽车运输浓硫酸 | 常温下浓硫酸与铁不反应 |
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738kJ/molI2=1451kJ/mol I3=7733kJ/molI4=10540kJ/mol |
D元素简单离子半径是该周期中最小的 |
E元素是该周期电负性最大的元素 |
F所在族的元素种类是周期表中最多的 |
G在周期表的第十一列 |

①稳定性:HCNHNC(填“>”、“<”或“=”)。
②该异构化反应的ΔH=。
则 ΔH=kJ/mol(用含a、b、c的计算式表示)。

t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=。
②该反应为(填“吸热”或“放热”)反应。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),则此时的温度为℃。
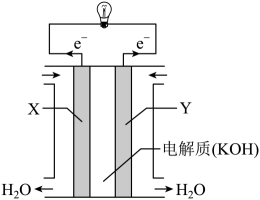
①飞船在光照区运行时,太阳能电池帆板将能转化为能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为:Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2 , 充电时,阳极的电极反应式为;当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性(填“增强”“减弱”或“不变”)。
②紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O2Ag+Zn(OH)2 , 其负极的电极反应式为。