实验编号 | 室温下,试管中所加试剂及其用量/mL | 实验温度/℃ | 溶液颜色褪至无色所需时间/min | |||
0.6 mol·L | 3 mol·L | 0.05 mol·L | ||||
Ⅰ | 2.0 | 2.0 | 3.0 | 20 | 2.6 | |
Ⅱ | 2.0 | 2.0 | 3.0 | T | 1.4 | |
Ⅲ | 2.0 | 3.0 | 2.0 | 3.0 | 45 | 1.0 |
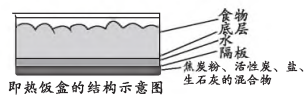
该即热饭盒“起热”原因主要与(填化学方程式)反应为放热反应有关。
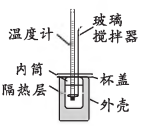
①实验中玻璃搅拌器的使用方法为(填“上下移动”、“左右移动”或“匀速旋转”)。
②实验中碱稍过量的原因为。
③实验测得反应前后体系的温度值分别为℃、
℃,则该过程放出的热量为J[c和ρ分别取4.18J/(g⋅℃)和1.0 g⋅mL
, 忽略水以外各物质吸收的热量,下同];实验发现,若用同体积同浓度的醋酸溶液代替实验中的盐酸,(
)℃减小,其原因为(用化学用语表示)。
序号 | 反应试剂 | 体系温度/℃ | ||
反应前 | 反应后 | |||
ⅰ | 0.20 mol·L | 1.36 g Zn | 25 | b |
ⅱ | 0.65 g Zn | 25 | c | |
①实验中应选择(填“Zn粉”或“Zn片”);温度:bc(填“>”“<”或“=”)。
②当时表明该方法可行。(保留1位小数)
请回答下列问题:

能代表CO浓度的曲线是(填“甲”、“乙”或“丙”);
简述随浓度增加,甲、乙曲线“开口”越来越大的原因:。

①在℃之前,随温度升高丙烯产率升高的原因可能是、;温度高于
℃时,丙烯产率迅速降低的原因可能是、。
②某温度下,向已达平衡状态的刚性容器中再充入一定量的丙烷,再次平衡后丙烷的转化率(填“减小”、“增大”或“不变”)。

①根据直线Ⅰ、Ⅱ可得出的结论是,其他条件相同时,。
②在Ⅱ条件下,50 min内平均分解速率为。
③若起始浓度
为0.400 mol⋅L
, 比较不同起始浓度时
的平均分解速率:v(
mol⋅L
)v(
mol⋅L
)。(填“>”“=”或“<”)
ⅰ.
ⅱ.
ⅲ.
ⅳ.
①O(填“>”或“<”)。
②该机理中,速率控制步骤为,理由是。
Ⅰ.工业上常用饱和溶液回收捕集废气中的
和
, 其流程为:
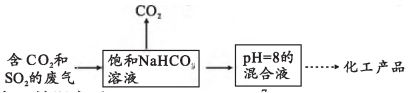
已知:该温度下,、
、
、
。
②的混合溶液中含碳微粒主要为(不考虑溶液中的
分子),
。
Ⅱ.工业上用与
催化合成甲醇,相关反应为:
相关反应 |
| 化学平衡常数(K) | |
ⅰ | |||
ⅱ | |||
ⅲ |
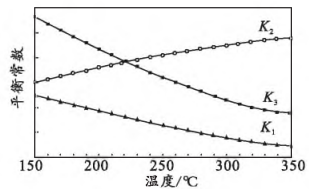
①0(填“>”或“<”),判断依据为。
②取值范围为。
①平衡时mol⋅L
。
②反应ii的化学平衡常数。