NaClO2+NaHSO4═ClO2+NaCl+Na2SO4+H2O
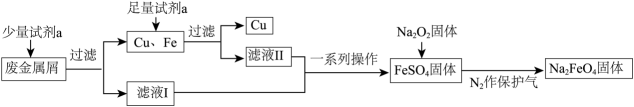
①某兴趣小组欲用固体配制100 mL
的高铁酸钠溶液,需要高铁酸钠固体的质量为g。配制所用的容量瓶上标有、、刻度线。
②下列操作导致浓度偏低的是。
A.容量瓶用蒸馏水洗净之后,直接用于溶液的配制
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切
D.定容时,俯视刻度线

①盛放浓盐酸的仪器名称是,A中发生反应的化学方程式为。
②用8.7 g 与足量浓盐酸充分反应,生成
的质量为。
制备“84消毒液”的离子方程式。
II.在2 mL 84消毒液中加入2 mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验I、II现象不同的原因是为。
②实验III中,随时间的变化ORP值不同的原因可能是。
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。已知某品牌84消毒液中次氯酸钠的质量分数为12.6%,若取该消毒液100 g,加水稀释为8%的溶液,需加水的质量为g。