A | B | C | D |
E | F | ||
G | H |
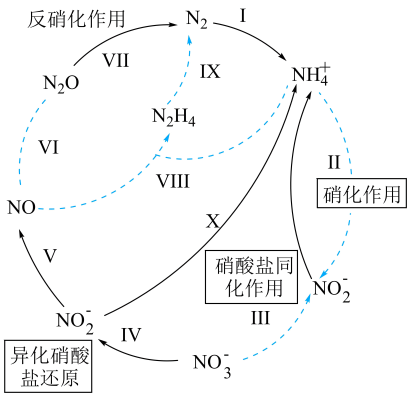
已知:硝化作用是在有氧的条件下,氨或铵根经亚硝酸细菌和硝酸细菌的作用转化为硝酸的过程。铵根浓度或pH过大,都会使硝化作用减弱。
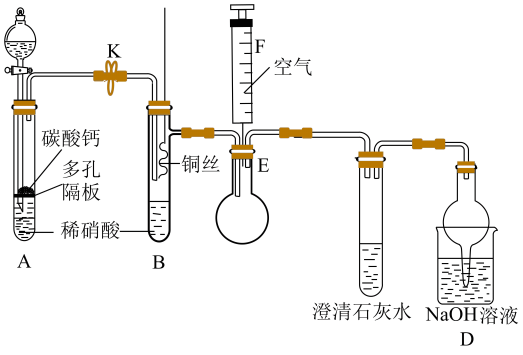
①实验前先打开开关K通入一段时间,其目的是。采用抽拉铜丝与稀硝酸反应的优点为。
②检验生成的气体为NO的操作是。
③装置D的作用是。
①已知还原性; , 写出酸性条件下加热时,
和KSCN(aq)反应的离子方程式:。
②与水反应生成的含氧酸的结构式为。氰化提金工艺在黄金生产领域仍占主导地位,但会产生大量含氰(
)废水,含氰废水中加入足量的
, 发生反应的离子方程式为
。理论上处理含氰废水(含
),需要消耗g
(保留2位小数)。按照理论值投放,含氰废水处理效果并不理想,请分析原因:。
化学键 | ||||
键能/( | 414 | 803 | 463 | 498 |
为了验证反应温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
实验编号 |
|
| 催化剂的比表面积/( | |
① | 280 | 82 | ||
② | ||||
③ | 350 | a | 82 |
控制变量是科学研究的重要方法,因此表中数据:,
。