①3Fe+NaNO2+5NaOH = 3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O → Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O = Fe3O4+4NaOH
①标准状况下,1 L HCl和1 L H2O的物质的量相同
②若一个硫原子的质量是ag,12C原子的质量是b g,NA只表示阿伏加德罗常数的数值,则该硫原子的摩尔质量为 g·mol-1或aNAg·mol-1
③物质A加热完全分解,分解方程式为 2AB+2C+3D且产物都是气体,测得生成的混合气体对氢气的相对密度为15,则A的相对分子质量为60
④物质的量相同的两种物质,则它们在标准状况下的体积也相同
⑤温度和容积相同的两容器中分别盛有5molO2和2molN2 , 则压强之比为5:2
⑥等温等压下,SO2气体与CO2气体的密度之比等于16:11

①将称量好的Na2CO3固体放入小烧杯中,加适量蒸馏水溶解。
②将Na2CO3溶液冷却到室温后,小心转入____中。
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都要小心转入容量瓶中,并轻轻摇匀。
④继续加蒸馏水至液面距刻度线1~2cm处,改用____滴加蒸馏水至溶液凹液面最低点与刻度线相切。
⑤将容量瓶瓶塞塞紧,充分摇匀。
回答下列问题:
①容量瓶用蒸馏水洗涤后未经干燥
②洗涤烧杯内壁后将洗涤液弃去
③转移溶液时,不慎有少量溶液洒出
④定容、摇匀后发现溶液的凹液面低于刻度线
⑤定容时,俯视容量瓶刻度线

【查阅资料】
i.该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
ii.KSCN中的硫元素为-2价。
iii.Fe(OH)3受热分解生成Fe2O3。
实验I.检验该补铁剂中铁元素的价态。
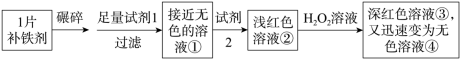
实验II.测定该补铁剂中铁元素的含量。

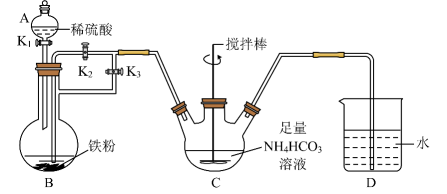
完成下列填空:
小组成员按上图连接好装置,检查装置气密性后加入药品,打开K1和K3 , 关闭K2。
仪器A中名称为。
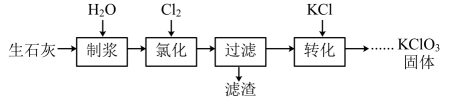
①可以通过缓慢通入的方法提高Cl2的利用率,二者反应生成Ca(ClO3)2的离子方程式为。
②Cl2与Ca(OH)2作用除生成Ca(ClO3)2外,还可能生成Ca(ClO)2 , 若生成含等物质的量氯元素的Ca(ClO3)2与Ca(ClO)2时,消耗的Cl2的物质的量之比为。
③“氯化”过程中会有少量Ca(ClO)2 , 经光照还会有少量无色无味气体生成,该气体可能是(填化学式)。

①Ca(ClO3)2的溶解度曲线是(填A或B),若溶液中KClO3的含量为100g•L-1 , 从该溶液中得到KClO3固体的方法是蒸发浓缩、、、洗涤。
②KClO3与SO2在强酸性条件下可反应制得ClO2 , SO2被氧化为S , 该反应的离子方程式为。