
已知:“流程Ⅱ”中反应为。
请回答下列问题:
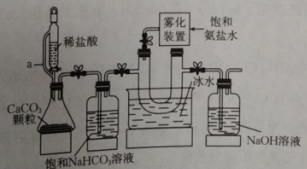
支管a的作用是,雾化装置的优点有。
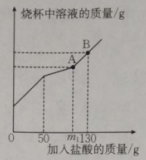
①该产品样品中,含碳酸钠的质量为(计算结果精确至)。
②A点时,此温度下所得不饱和溶液中溶质质量分数为(计算结果精确至0.1%)。

①如图中盛有碱石灰的仪器名称是。实验室制备NO的反应的离子方程式为。
②实验室制备可选择图中的装置(填标号);制备并收集干燥的
的装置连接顺序:a→(按气流方向,用小写字母表示)。
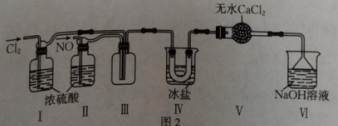
①装置Ⅰ、Ⅱ除可进一步干燥NO、外,另一个作用是。
②装置Ⅳ的作用是;若无装置Ⅴ,则装置Ⅳ中可能发生反应的化学方相式为。
③查阅资料知,王水是浓硝酸与浓盐酸的混合酸,一定条件下该混合酸可自身反应生成亚硝酰氯、氯气和水,该反应的化学方程式为。
②
③
则与
反应生成
和
的热化学方程式为。该反应在(填“高温”或“低温”)下可自发进行。

该反应的决速步骤是反应(填对应序号);中间产物的化学式为。

工作时,多孔电极a为极,多孔电极b处发生的电极反应为。
①内,
, NO转化率=(保留三位有效数字)%。
②此温度下,该反应的平衡常数(
是用平衡分压代替平衡浓度计算的平衡常数)。
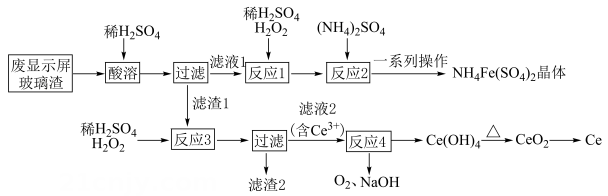
已知:不溶于稀硫酸,也不溶于
溶液。
回答下列问题:
①溶液 ②
溶液 ③
溶液