一、元素周期表的确立是化学发展史上的里程碑。我们往往可以通过元素在周期表中的位置,对某些不熟悉元素的性质及用途做出预测。
-
1.
下列具有特殊性能的材料中,由主族元素和副族元素形成化合物的是( ) (单选)。
A . 半导体材料砷化镓
B . 吸氢材料镧镍合金
C . 透明陶瓷材料硒化锌
D . 超导材料K3C60
-
2.
下列事实不能用元素周期律解释的是( )(单选)。
A . F2在暗处遇H2爆炸,I2在暗处遇H2几乎不反应
B . Br2和NaI溶液发生置换反应,和NaCl溶液不发生置换反应
C . 金属Na和熔融KCl反应置换出金属K
D . 常温下,NaCl溶液的pH=7,AlCl3溶液的pH<7
-
3.
短周期元素X、Y、Z、M、N、W原子序数依次递增,六种元素形成的一种化合物结构如图所示,其中元素Z最外层电子数为内层电子数的3倍。其中元素Z最外层电子数为内层电子数的3倍。下列说法正确的是( )(单选)。

A . 最高价氧化物对应水化物的酸性W>Y>N
B . 元素Z与其他五种元素均可形成2种及以上化合物
C . 简单离子半径Z>M>W
D . 元素X与其他五种元素均可形成共价化合物
-
4.
在地壳里硅的含量在所有元素中居第二位,仅次于氧。接下来我们尝试利用元素周期表,通过与其相邻元素类比来了解硅的一些特点。
-
-
(2)
晶体硅的结构和金刚石结构相似,碳化硅(SiC)也是一种具有类似于金刚石结构的晶体,其中碳原子核硅原子的位置是交替的。在①金刚石,②晶体硅,③碳化硅这三种晶体中,它们的熔点从高到低的顺序是( )(单选)。
A . ①③②
B . ③②①
C . ③①②
D . ②①③
-
(3)
与铝类似,硅也能溶于强碱溶液并生成硅酸根(SiO₃²⁻)。写出硅与氢氧化钠反应的离子方程式:。
-
(4)
比较元素非金属性:SiP(选填“<”或“>”),给出 个可以用来说明该结论的化学事实是:。
-
(5)
二氧化硅一般不能与酸反应,但可以与氢氟酸发生如下反应:
 二氧化硅属于(选填“酸性”、“碱性”或“两性”)氧化物。该反应涉及的所有元素中原子半径最小的是(填元素符号),生成物中属于极性分子的是(填化学式)。
二氧化硅属于(选填“酸性”、“碱性”或“两性”)氧化物。该反应涉及的所有元素中原子半径最小的是(填元素符号),生成物中属于极性分子的是(填化学式)。
二、
-
5.
汉弗里·戴维是英国著名化学家,他提出:“电流与化合物的相互作用,是最有可能将所有物质分解为元素的方法。”通过这种方法,他制备得到了金属钾和钠。
-
(1)
戴维在1807年用电解熔融烧碱的方法制得金属钠,电极之间设置镍网做隔膜以分离电解产物,电解的总反应方程式为:。
-
(2)
关于金属钠,下列叙述正确的是( )(单选)。
A . 钠可保存在煤油或CCl₄等液态有机物中
B . 氯化钠在电流作用下电离出的钠离子和氯离子
C . 钠与硫在常温下化合就能剧烈反应,甚至发生爆炸
D . 若金属钠着火,可采用干粉灭火器灭火
-
-
(4)
ag钠完全燃烧后,将固体充分溶解在bg水中,所得溶液溶质的质量分数是。
-
6.
某实验小组把CO₂通入饱和

溶液制取

装置如下图所示(气密性已检验,部分夹持装置略):
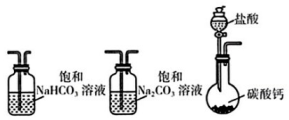
-
(1)
选取必要的实验装置,正确的连接顺序为
(填序号)。
为确定制得的固体样品是纯净的 小组同学提出下列实验方案:
小组同学提出下列实验方案:
甲方案:将样品溶液与BaCl₂溶液反应,观察现象
乙方案:测定pH法
-
(2)
为判定甲方案的可行性,某同学用)

分析纯配制的溶液,与

溶液等体积混合进行实验,结果如下:
 溶液 溶液  溶液 溶液
| 0.1mol⋅L⁻¹ | 0.1mol⋅L⁻¹ | 0.02mol⋅L⁻¹ |
0.2mol⋅L⁻¹
| 浑浊 | 浑浊 | 少许浑浊 |
0.1mol⋅L⁻¹
| 浑浊 | 少许浑浊 | 无现象 |
0.02mol⋅L⁻¹
| 少许浑浊 | 无现象 | 无现象 |
此实验说明甲方案(填“可行”或“不可行”)。
-
-
(4)
乙方案是:取等质量的固体样品和分析纯

加等质量的水配制的溶液,分别与pH计测定pH,pH值更大的是
(填化学式)。
三、
-
7.
以硫酸厂矿渣(含Fe₂O₃、α-Al₂O₃、SiO₂等)为原料制备铁黄[FeO(OH)]的一种工艺流程如图所示:

资料:i. α-Al₂O₃化学性质极不活泼,不溶于水也不溶于酸或碱, γ-Al₂O₃不溶于水,可溶于强酸或强碱
ii.KₛₚCaCO₃=2.8×10⁻⁹;KₛₚFeCO₃=2×10⁻¹¹。
-
(1)
将mg含Fe₂O₃·nH₂O的

溶于200mLpH=1的硫酸溶液中,然后加入100mL氨水,使溶液中的Fe³⁺和Al³⁺恰好完全沉淀,则所加氨水的浓度为( )(单选)。
A . 0.2mol/L
B . 0.1mol/L
C . 0.05mol/L
D . 0.02mol/L
-
(2)
向“酸浸”后的溶液中加入KSCN,溶液会变红,变红过程发生的离子方程式是。
-
-
(4)
“沉铁”过程中铁元素大部分转化为 FeCO₃,但往往有副产物Fe(OH)₂生成,分析原因是。
-
(5)
若用CaCO₃“沉铁”, 则无副产物Fe(OH)₂产生,当反应完成时,溶液中

。
-
(6)
下列物质中可以通过化合反应制备得到的是( )(双选)。
A . FeCl₂
B . Fe(OH)₂
C . Fe(OH)₃
D . Fe₂O₃
-
(7)
写出氧化过程生成铁黄的化学方程式
。
为确定“滤液”中Fe²⁺的物质的量浓度,选用K₂Cr₂O₇标准溶液滴定溶液中的Fe²⁺,离子方程式为 (未配平)。
(未配平)。
-
(8)
向滴定管中注入K₂Cr₂O₇标准溶液前,滴定管需要检漏、用蒸馏水洗涤和。
-
(9)
若滴定xmL“滤液”中的Fe²⁺,消耗amol·L⁻K₂Cr₂O₇标准溶液bmL,则滤液中


四、题目
-
8.
以下是有关铝的实验探究,请回答相关问题:
-
(1)
用铝粉和Fe₂O₃做铝热反应实验,需要的试剂还有( )(双选)。
A . KCl
B . KClO₃
C . MnO₂
D . Mg
-
(2)
镁能发生和铝类似的“镁热反应”,写出镁在高温下和

反应的化学方程式
。
-
(3)
向集满CO₂的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:。
-
(4)
向铝粉中添加少量NH₄Cl固体并充分混合,将其加热到1000℃时可与N₂反应制备AlN,下列说法正确的是( )(单选)。
A . AIN是一种金属材料
B . AIN与足量氢氧化钠溶液共热时生成氢氧化铝和氨气
C . 少量NH₄Cl能够破坏Al表面的Al₂O₃薄膜
D . AIN与足量盐酸反应的离子方程式为
-
(5)
用打磨过的铝片进行如下实验,下列分析不合理的是( )(单选)。

A . ①中铝片发生了钝化
B . ②中产生的气泡是氮氧化合物,不是氢气
C . ③中沉淀溶解的离子方程式是Al(OH)₃+OH⁻=[Al(OH)₄]⁻
D . ②中加水稀释过程中,仅发生了氧化还原反应
-
(6)
为探究铝片(未打磨)与Na₂CO₃溶液的反应,实验如下:

| 
|
无明显现象 | 铝片表面产生细小气泡 | 出现白色沉淀,产生大量气泡(经检验为H₂和CO₂) |
下列说法不正确的是( )(单选)。
A .  溶液中存在水解平衡:
溶液中存在水解平衡: B . 对比Ⅰ、Ⅲ,推测Na₂CO₃溶液能破坏铝表面的氧化膜
C . Ⅳ溶液中可能存在大量Al³⁺
D . 推测出现白色浑浊的可能原因:
B . 对比Ⅰ、Ⅲ,推测Na₂CO₃溶液能破坏铝表面的氧化膜
C . Ⅳ溶液中可能存在大量Al³⁺
D . 推测出现白色浑浊的可能原因:
-
(7)
某铝土矿的主要成分为

, 还含有Fe₂O₃和SiO₂杂质。称取17.50g铝土矿样品,加入 200mL1.65mol/L的稀硫酸,恰好完全反应,过滤得沉淀0.30g,然后在滤液中加入足量的NaOH溶液,得到沉淀2.14g。
①该试样中Fe₂O₃的物质的量为mol。
②样品中 的
的 =。
=。
五、
-
9.

作为化石燃料燃烧产生的废气,是主要的温室气体之一。使用电化学方法能够对(

进行吸收。利用活泼金属与二氧化碳的反应,能够构建金属

电池。其中一种

电池的模型如下图所示:(图中

是固体)。

-
(1)
下列有关该原电池的说法中,正确的是( )(单选)
A . 该原电池工作时,电子由正极向负极移动
B . 在该原电池中,石墨作为负极
C . 原电池工作时,正离子一定向正极方向移动
D . 原电池工作时,b电极发生氧化反应
-
(2)
给出该原电池的正极反应以及总反应。
正极:
总反应:
-
(3)
原电池中每转移1mol电子,能够吸收molCO₂。
-
(4)
若二氧化碳中混有氧气,那么在a电极上会出现可能会出现的杂质是。
-
(5)
利用电解池,通过电化学还原,CO₂能够被还原为低价碳化合物。一种电化学还原二氧化碳的装置能够将二氧化碳还原为甲酸(HCOOH),该装置中,石墨作为阳极,单质银作为阴极,电解质溶液是硫酸溶液。
在该装置中,应该向极(填“阴”或“阳”)附近通入CO₂气体。
-
-
(7)
下列做法中,能够加速CO₂吸收速率的是( )(双选)。
A . 适当增大电源电压
B . 适当降低电解液温度
C . 适当缩小两电极间距
D . 适当降低通入CO₂的速度
-
(8)
当电极上生成5.6L(标准状况)的氧气时,生成甲酸的质量为g。
二氧化硅属于(选填“酸性”、“碱性”或“两性”)氧化物。该反应涉及的所有元素中原子半径最小的是(填元素符号),生成物中属于极性分子的是(填化学式)。

小组同学提出下列实验方案:

(未配平)。

的
=。
