一、 <strong><span>元素化学(23分)</span></strong>
-
1.
Cl2和ClO2都是重要的杀菌消毒剂,某实验兴趣小组制备Cl2和ClO2并验证其性质,设计实验如图(部分夹持装置略去)。回答下列问题:
-
(1)
I.Cl2的制备和性质验证

氯元素在元素周期表中的位置
周期
族;
-
(2)
氯原子最外层的核外电子排布式为;氯气的电子式,次氯酸的结构式是 ;
-
-
(4)
实验时装置A中盛放浓盐酸的仪器通常换成装置F,请写出装置F的名称
,用F代替分液漏斗的原因是
。
在实验过程中用含0.4molHCl的浓盐酸无法完全溶解8.7gMnO2的原因是。
-
-
-
(7)
将制备的Cl2通入冷的石灰乳中可以制备漂白粉,该反应的化学方程式为。
-
(8)
Ⅱ.ClO
2的制备
KClO3和浓盐酸在一定温度下反应会生成黄绿色的二氧化氯ClO2。其变化可表述为:KClO3+HCl(浓)—KCl+ClO2↑+Cl2↑+H2O(未配平)。
下列有关该反应的叙述正确的是( )。
A . 浓盐酸在反应中只表现出还原性
B . 氧化剂与还原剂的个数比为1∶2
C . 氧化产物与还原产物的分子个数比为1∶1
D . 反应中产生n个ClO2分子时,转移n个电子
-
(9)
有效氯是指单位质量的含氯消毒剂相当于多少克Cl2的消毒能力,则ClO2的有效氯为g(保留3位有效数字)。
二、<strong><span>化学原理(45分)</span></strong>
-
2.
在某温度下,5L密闭容器内发生如下反应:
CH4(g)+H2O (g) CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
-
-
(2)
一个可逆反应的平衡常数只随温度而变化,请写出该反应的平衡常数表达式,当温度升高,该平衡常数(填“增大”、“减小”或“不变”)
-
(3)
反应20min后生成了18g氢气,甲烷的平均反应速率为。
-
(4)
下列选项中的物理量不变时,一定可以判断反应达到平衡的是( )。(双选)
A . 氢元素的质量分数
B . 容器内的压强
C . 反应的平衡常数
D . 容器内气体的平均分子量
-
(5)
在某一时刻,
v正=
v逆=
v , 此时反应达到平衡。若改变一条件,可使得
v正<
v逆<
v , 指出可以改变的条件
,
A.升高温度 B.增大压强 C.降低温度 D.降低压强
并说明理由:。
-
(6)
已知CO与H
2合成CH
3OH是可逆反应:CO+2H
2
CH
3OH。
试求:当投料比n(CO):n(H2)=时,平衡时CO与H2的转化率相同。
-
3.
氧化铝法制取无水三氯化铝的反应如下:
____Al2O3(s)+____C(s)+____Cl2(g)  ____AlCl3(g)+____CO(g)
____AlCl3(g)+____CO(g)
-
(1)
配平上述方程式,并用单线桥法标出上述反应的电子转移方向和数目。
-
(2)
Al2O3是离子晶体,AlCl3是分子晶体,在工业上通常采用电解熔融态的Al2O3来进行制备单质铝,请从晶体结构角度说明原因:。
-
(3)
铝盐可以用于做净水剂,请写出Al3+水解的离子方程式:。
-
4.
化学反应过程中释放或吸收的热量在生活、生产、科技及科研中应用广泛。
-
(1)
制作冷敷袋可利用(填“放热”或“吸热”)的化学变化或物理变化。
-
(2)
“即热饭盒”为生活带来便利,它可利用下面( )(填字母)反应放热加热食物。
A . 浓硫酸和水
B . 生石灰和水
C . 纯碱和水
D . 食盐和白醋
-
(3)
已知:

与足量

充分燃烧生成液态水时放出

热量。
①该反应的能量变化可用图中的 (填字母)表示。

②写出 燃烧生成液态水的热化学反应方程式。
燃烧生成液态水的热化学反应方程式。
-
(4)
某反应过程中能量变化如图所示,下列有关叙述正确的是( )。

A . 该反应为放热反应
B . 催化剂改变了化学反应的热效应
C . 催化剂不改变化学反应过程
D . 反应中断开化学键吸收的总能量高于形成化学键放出的总能量
-
(5)
计算化学反应中的能量变化有多种途径。
①通过化学键的键能计算。已知:
计算可得:


②通过盖斯定律计算。已知:




写出 与
与 反应生成
反应生成 的热化学方程式:。
的热化学方程式:。
-
(6)
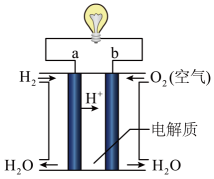
化学能与其他能量间的转换在生活中处处可见,比如某种氢氧燃料电池已经成功应用在城市公交汽车上,该电池用

溶液作电解质溶液,其简易装置如图所示。
在这个燃料电池中,正极的电极反应为。若在标况下,消耗了33.6L的氢气,此时电路中转移的电子数目为个(用阿伏加德罗常数表示)。
三、<strong><span>有机化学(32分)</span></strong>
-
5.
如图,现有三种氨基酸,最多能合成不同结构的二肽的种类( )。

A . 12种
B . 9种
C . 6种
D . 3种
-
6.
某多肽分子结构如下:

-
-
(2)
写出该多肽分子水解产生的各种氨基酸的结构简式、、 、
-
A .  B . CHCl3
C . CH3CH2OH
D . (CH3)2CHCHO
B . CHCl3
C . CH3CH2OH
D . (CH3)2CHCHO
-
8.
丙烯酸乙酯(D)是一种食品用合成香料,可用以下方法合成:

请回答:
-
(1)
工业生产乙烯和丙烯主要来自于石油的( )。
A . 干馏
B . 分馏
C . 裂化
D . 裂解
-
(2)
乙烯的碳原子之间存在、键(从原子轨道重叠方式分析),乙烯中碳原子杂化方式为。(填“sp”、“sp2”或“sp3”)
-
-
(4)
医用口罩中的过滤层所用的材料是熔喷聚丙烯,请写出写出聚丙烯的结构简式。
-
-
(6)
B中的官能团名称、,并简述检验 B 中含氧官能团的化学方法:。
-
(7)
X是 B 的同分异构体,X 能与 Na 反应且能使溴水褪色,写出一种X的结构简式为。(已知羟基接在不饱和碳上的结构不稳定。)
-
(8)
利用学过的知识,写出由乙烯(CH
2=CH
2)为原料制备

的合成路线(无机试剂任用)(合成路线常用的表示方式为:甲

乙∙∙∙∙∙∙

目标产物)

CO(g)+3H2(g) △H>0

燃烧生成液态水的热化学反应方程式。

与
反应生成
的热化学方程式:。

