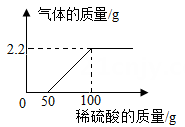
 制取氧气
B .
制取氧气
B .  排水法收集氧气
C .
排水法收集氧气
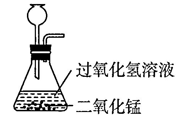
C . 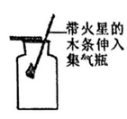 检验氧气
D .
检验氧气
D . 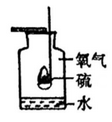 硫在氧气中燃烧
硫在氧气中燃烧
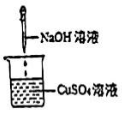 B .
B . 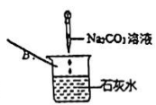 C .
C . 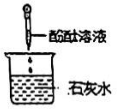 D .
D . 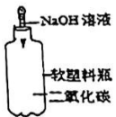


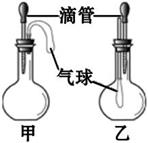
| 甲 | 乙 | |
| A. | 稀硫酸和铜片 | 水和硝酸铵固体 |
| B. | 水和氢氧化钠固体 | AgNO3溶液和稀盐酸 |
| C. | 双氧水和MnO2 | NaOH溶液和CO2 |
| D. | Na2CO3溶液和稀硫酸 | 水和浓硫酸 |
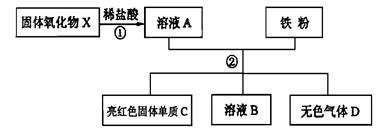

①H2 ②O2 ③CO2
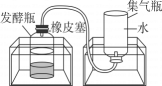
步骤一:从池塘中挖取含有微生物的污泥,并去除杂质。
步骤二:将适量的有机厨余、水、污泥均匀混合后,分成三等份,分别置于三个发酵瓶中,再将发酵瓶分别放入三个不同温度的恒温水浴锅中。每隔24小时测量集气瓶中的排开水量并记录。
步骤三:每次检测后,将集气瓶重新装满水再放回水槽中,继续收集气体,实验结果如表所示。
水浴温度/℃ | 排开水量/g | ||||
第一天 | 第二天 | 第三天 | 第四天 | 第五天 | |
24 | 30 | 110 | 160 | 182 | 172 |
28 | 55 | 175 | 278 | 212 | 181 |
34 | 107 | 501 | 431 | 170 | 153 |
 B .
B . 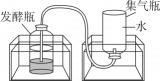 C .
C . 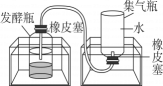 D .
D . 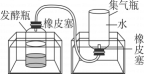
【猜想与假设】
久置的氢氧化钠固体的成分有下面3种可能情况:
猜想一:只有氢氧化钠
猜想二:
猜想三:只有碳酸钠
【实验探究】
实验方案 | 实验现象 | 结论 |
将固体放入试管中,加蒸馏水完全溶解,然后滴加足量的BaCl2溶液 | ▲ | 猜想一不成立 |
上方表格空格填空
为了进一步验证是猜想二还是猜想三成立,活动小组的同学们又提出了一个实验方案。经过实验测定,上述实验探究后的溶液的pH>7,得出结论:猜想成立。
【反思与交流】
氢氧化钠暴露在空气中容易变质,其主要原因是 (用化学方程式表示),因此实验室中氢氧化钠固体必须密封保存。
|
加热时间 |
t1 |
t2 |
t3 |
t4 |
|
剩余固体质量/g |
2.48 |
2.34 |
2.04 |
2.04 |