I.常温下,空气中的氮气和稀有气体不会与镁发生反应。
II.无水CaCl2固体有较强的吸水性,能吸收空气中的水蒸气。
为探究镁表面黑色物质的成因是与空气中的哪些成分有关,他开展如图实验进行探究。
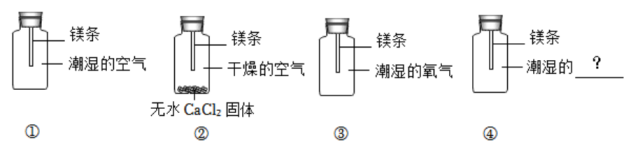
数日后第①组镁条表面出现黑色物质,第②、③组只观察到镁条表面变暗,并没有出现黑色物质。

【猜想假设】
猜想一:只含有KOH;
猜想二:含有KOH、;
猜想三:KOH、Ca(OH)2
【设计实验】
实验步骤 | 实验现象 | 实验结论 |
1.取溶液少许于试管中,滴加过量稀盐酸 | 无明显现象 | 猜想二不正确 |
2.取溶液少许于试管中,滴加少许K2CO3溶液 | 猜想三正确 |
【交流反思】
含有KOH、Ca(OH)2的废水直接排放会造成水体污染。小组同学对废水做如图处理。
C烧杯中出现现象时,说明水中已无KOH、Ca(OH)2。
①滴入酚酞溶液无明显现象②测得试管中溶液的pH小于7
③滴入BaCl2溶液有白色沉淀出现④滴入CuCl2溶液无蓝色沉淀出现

实验步骤 | 实验现象 |
步骤1:将试管A中物质全部倒入试管E中 | 产生气泡且白色沉淀增加 |
步骤2:过滤,得到滤液 | / |
步骤3:向滤液中逐滴滴加氢氧化钠溶液 | 开始无明显现象,一段时间后出现白色沉淀 |
①步骤2得到的滤液中,一定含有的溶质是(填化学式)。
②步骤3中,产生的白色沉淀是(填化学式)。
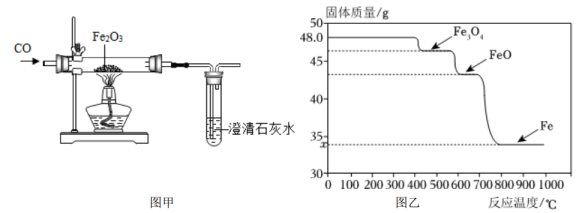
大家对乙同学提出的质疑进行分析和验证。
①用CO炼铁时,还原Fe2O3的温度应不低于℃。(填“400”“600”或“800”)
②该小组查阅资料得知酒精灯加热温度为600℃左右,他们发现上述对黑色固体成分的检验结果与图像有矛盾,推测黑色固体在冷却过程中发生了以下反应:=Fe3O4+Fe。
③在适合的条件下,Fe2O3全部被还原成Fe,则图中:x=。