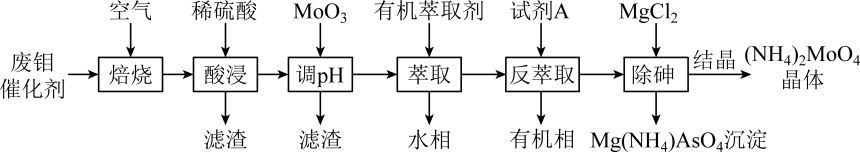
注:酸浸后钼元素以MoO形式存在。
回答下列问题:
已知:溶液中某离子浓度≤10-5mol•L-1时,认为沉淀完全;常温下Ksp[Fe(OH)3]=10-38.5 , Ksp[Cu(OH)2]=10-19.6。
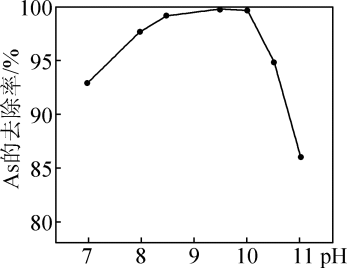
已知:(NH4)3H4PMo12O42•H2O+26NaOH=12Na2MoO4+Na2HPO4+3NH3↑+17H2O。
Ⅰ.制备硫代硫酸钠
反应原理:。实验装置如图所示。
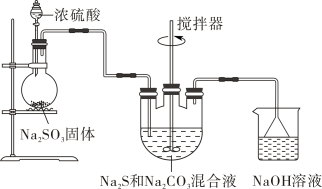
在和
的混合溶中不断通入
气体,三颈烧瓶中的现象为:
①浅黄色沉淀逐渐增多。原理为:
②浅黄色沉淀保持一段时间不变,有无色无味气体产生。原理为:
③浅黄色沉淀逐渐减少。
④继续通入 , 浅黄色沉淀又逐渐增多。原理为:
经预处理的芯片中含有游离态的Au,用单一的溶液处理,金的浸取率极低。
向浸取液中通入空气使Au转化为稳定性高的
, 该反应的离子方程式为。


①向银氨溶液中加入溶液,离心分离、洗涤干燥后可得到
高效光催化剂,写出反应的离子方程式为。
②和
在溶液中反应也可制得
固体,但制得的
固体光催化性能极差。从速率角度解释其原因是。
