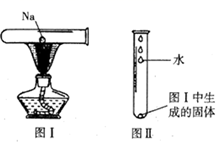
①钠投入水中,先沉入水底,后浮出水面②钠立即与水反应,并有气体产生③反应后溶液变红④钠熔成闪亮的小球⑤小球在水面上四处游动⑥有“嘶嘶”的响声发出
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 用铁丝蘸取某种粉末做焰色试验 | 火焰呈黄色 | 证明含有钠单质 |
| B | 将饱和氯化铁溶液滴入沸水中 | 产生某种红褐色液体 | 该红褐色液体为胶体 |
| C | 用红色激光笔照射雾 | 看到一条光亮的“通路” | 雾能产生丁达尔效应 |
| D | 加热碳酸氢钠溶液 | 产生能使澄清石灰水变浑浊的气体 | 碳酸氢钠热稳定性较差 |
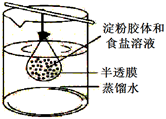
高铁酸钾在与水反应过程中,O2是 (填“氧化产物”或“还原产物”),每当反应生成8gO2 , 被氧化的水质量是g。说明该净水剂的净水原理。
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 醋酸 | 酒精 | 火碱 | 食盐 | 苏打 | 小苏打 | 铜丝 |
成分 |

:;
:;
:。

请回答下列问题:
回答下列问题:
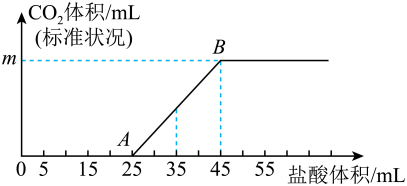
①0A段发生反应的离子方程式为。
②m=mL。
③原②溶液的物质的量浓度为。
步骤 | 实验操作 | 观察到的实验现象 | |
① | 在两支试管中分别加入 | 放置至室温时,全部溶解,得到透明溶液 | 放置至室温时,部分溶解,试管底部有少许固体 |
② | 将步骤①的试管中溶液分别分成两份,其中1份溶液中各滴加2滴酚酞溶液 | 溶液变红色 | 溶液变浅红色 |
③ | 在步骤②的另两份溶液中各滴加2滴10%盐酸,振荡 | 没有气泡产生 | 产生少量气泡 |
室温时,的溶解度大于
的实验证据是。
编号 | 实验操作 | 实验数据 |
④ |
|
|
⑤ |
|
|
信息提示:溶液越小,
的浓度越小,溶液碱性越弱。
实验④中,溶解时吸收热量的物质是(填化学式)。

观察到的实验现象如下表所示:
物质 | 装置B中现象 | 装置C中现象 |
无明显变化 | 开始断断续续产生气泡,一会儿后,没有气泡,溶液保持澄清 | |
白色粉末变蓝色 | 开始断断续续产生气泡,一会儿后,产生连续气泡,溶液变浑浊 |
根据上述实验现象,回答下列问题:
加热时,装置C中产生气泡的原因是。
药品 | NaNO2 (亚硝酸钠) |
性质 | ①在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; ①AgNO2是一种难溶于水、易溶于酸的盐。 |
该反应中氧化剂是;若有0.75mol 电子转移,则被还原的氧化剂粒子数为。
以上物质中属于电解质的是(填序号),以上物质中属于非电解质的是(填序号),上述状态下的物质能导电的是(填序号)。
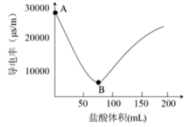
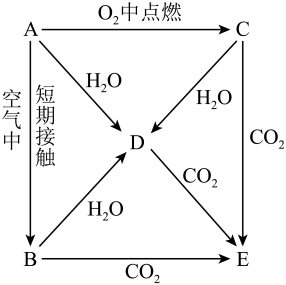
A~B段,发生的离子反应方程式是:。
a.均属于电解质 b.溶于水立即加入酚酞试液最终均为红色
c.均能通过化合反应一步生成 d.溶于水均伴随着放热现象
实验1:加热碳酸氢钠固体,装置如下图所示。
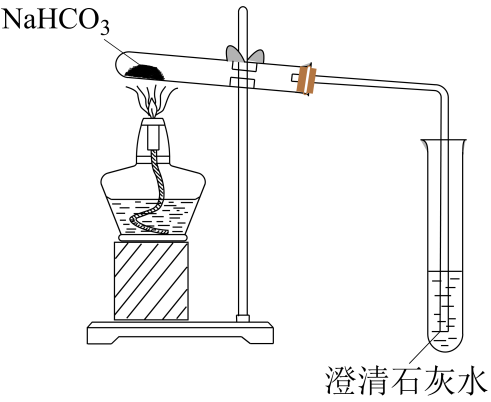
①利用上述装置可实现向
的转化,被加热的试管中发生反应的化学方程式为。
实验2:分别向滴有2滴酚酞的和
溶液中滴加稀盐酸,实验记录如下:
实验内容 | 实验现象 |
实验2-1 | 溶液浅红色褪去,立即产生大量气泡。 |
实验2-2 | 开始时,溶液的红色没有明显变化,电没有明显的气泡产生。继续滴加盐酸,当溶液的红色明显变浅时,气泡的数量血逐渐增多。当溶液的颜色变为浅红色,继续滴加盐酸,溶液的浅红色褪去,有大量气泡出现。 |
②实验2-1中,反应的离子方程式是。
③实验2-2中,实现碳酸钠向碳酸氢钠转化的现象是,反应的化学方程式:。
④碳酸也可实现上述转化,写出将通入
溶液中发生反应的离子方程式:。