

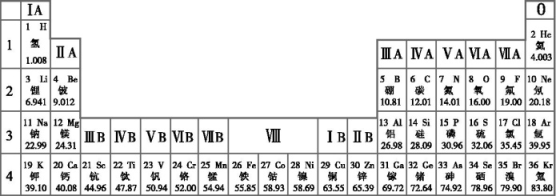
①地壳中最多的金属元素是铝,也就是金属铝
②地壳中非金属元素的总含量大于金属元素,种类少于金属元素
③人体中只含有非金属元素,没有金属元素
④人体中氢、氧元素含量很高,这与水占人体质量的70%以上有关


| 元素名称 | 钠 | 铁 | 铝 | 氢 | 氯 | 氧 | 硫 |

1829年,德国化学家德贝纳提出了锂钠钾、钙锶钡、磷砷锑、氯溴碘等15种元素,他把这些元素称为“三元素组”。
1864年,德国化学家迈耶,按相对原子质量递增顺序制定了一个“六元素表”。
1865年,英国化学家纽兰兹按相对原子质量递增顺序,将已知元素作了排列。发现第八个元素就与第一个元素性质相似(元素的排列每逢八就出现周期性)。这好像音乐上的八个音阶一样重复出现,于是提出“八音律”的理论(下表是“八音律表”的前部分)。
| H | Li | G | Bo | C | N | O |
| F | Na | Mg | Al | Si | P | S |
1869年,俄罗斯化学家门捷列夫对当时已知的63种元素的相对原子质量和物理性质(熔点、密度等)进行了比较,直到19世纪末才制成了第一张元素周期表。事实上,在1869年,德国的迈耶和俄国的门捷列夫几乎同时发现了元素周期律。分析上述科学史料,并结合当代的元素周期表的相关知识回答:
| 时间 | 人物 | 对“原子—分子”的认识 |
| 1803年 | 道尔顿 | 元素由微小的不可分的原子组成;不同元素的原子以简单数目比形成不可再分的原子——“复杂原子”。 |
| 1809年 | 盖·吕萨克 | 在同温同压下,相同体积的不同气体中含有相同数目的原子(包括“复杂原子”)。 |
| 1811年 | 阿伏加德罗 | 提出分子学说。引入分子概念,指出分子与原子的区别和联系。随后科学家们确立并逐步完善了“原子—分子”学说。 |
| 1897年 | 汤姆生 | 提出电子嵌于原子表面的枣糕型原子结构,否定了“原子不可再分“的观点。 |
| 1903年 | 卢瑟福 | 用a粒子轰击金箔的实验,推翻了汤姆生提出的原子结构模型,为建立现代原子理论打下了基础。 |


| H | N | ② | He | ||||
| ① | Ne | ||||||
| ③ | Ar |

实验做法如图

⑴放射源-放射性物质放出α粒子(带正电荷),质量是电子质量的7000倍;
⑵金箔-作为靶子,厚度 lum(1um=10-6m), 重叠了3000层左右的原子;
⑶荧光屏- α粒子打在上面发出闪光;
⑷显微镜-通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况.
【收集证据】绝大多数a 粒子穿过金箔后仍沿原米的方向前进,只有少数a 粒子却发生了较大的偏转,并 且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来.
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果 却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的.
【解释与结论】
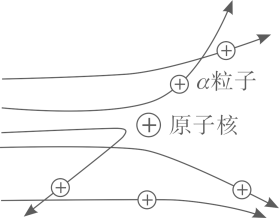
现象 1:大多数α粒子能穿透金箔而不改变原来的运动方向。
现象 2:一小部分α粒子改变原来的运动方向。
现象 3:极少数α粒子被弹了回来。

