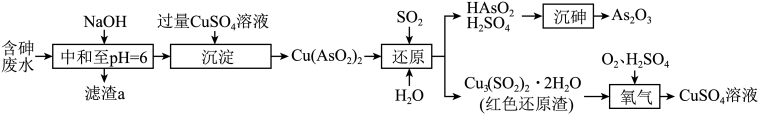
已知:Ksp[Fe(OH)3]=2.8 ×10-3920 ,Ksp[Cu(OH)2]=2.2 ×10-22 , Ksp [Bi(OH)3]=4.4 ×10-31。
回答下列问题:


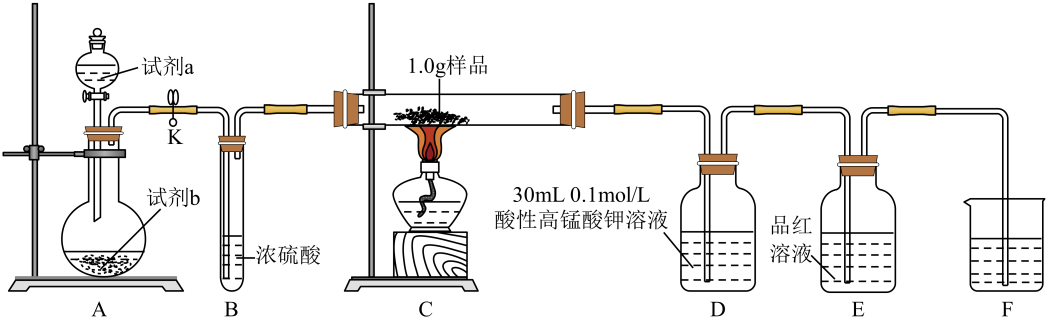
已知: i.样品的主要成分为FexSy , 含少量不溶于水、盐酸,且不参与装置C中反应的杂质;
ii. Mn2+在稀溶液中近乎无色。
实验步骤:
①按图连接装置,进行气密性检查,然后装入相应的药品;
②通入氧气并加热,装置C中固体逐渐转变为红棕色;
③待固体完全转化后,取装置D中的溶液6 mL于锥形瓶中,用0.1 mol·L-1的H2C2O4(草酸)溶液滴定。滴定共进行3次,平均消耗草酸溶液5.0 mL(假设装置D中溶液体积反应前后不变);
④取装置C中的残留固体于烧杯中,加入稀盐酸,充分搅拌后过滤;
⑤向滤液中加入足量氢氧化钠溶液,出现沉淀。过滤后取滤渣灼烧,得0.32 g固体。
回答下列问题:
a.步骤⑤灼烧滤渣不够充分
b.配制草酸标准液时,定容操作俯视刻度线
c.滴定时,草酸溶液不小心滴到锥形瓶外几滴
d.放出草酸的滴定管尖嘴部分滴定前无气泡,滴定终点时有气泡
C(s)+O2(g)CO2(g) ΔH2= - 393.5 kJ·mol-1;
2NO(g)N2(g)+O2(g) ΔH3=-181 kJ·mol -1。
C(s)与NO2(g)反应生成N2(g)和CO2(g)的热化学方程式为;关于该可逆反应,改变下列条件,一段时间后,正反应速率增大的是 (填字母)。
A.恒温下,缩小反应容器体积
B.恒容下,降低反应温度
C.恒温恒容下,通入一定量的N2
D.恒温恒容下,将CO2移出容器

①表示v正的直线是 (填“A”或“B")。
②T ℃时,该反应的平衡常数K=。
③T ℃时,向刚性容器中充入一定量NO2 , 平衡后测得c(NO2)为0.1 mol·L-1 , 平衡时NO2的转化率为(保留一位小数)。平衡后v逆=(用含a的表达式表示)。
④上题③中的反应达到平衡后,其他条件不变,继续通定量入一的NO2 , NO2的平衡浓度将 (填“增大”“减小”或“不变”)。

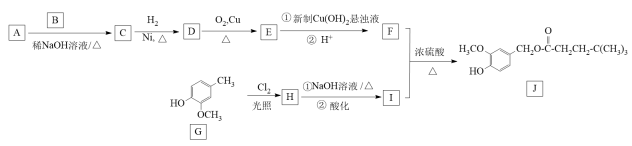
已知: I. A分子中含有两种不同环境的氢,且个数之比为9:1;
Ⅱ. ,其中R1、R2为氢或烃基。
,其中R1、R2为氢或烃基。
回答下列问题:
①含有苯环; ②只含一种含氧官能团; ③1 mol该有机物可与3 mol NaOH反应。