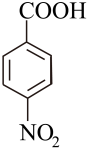
 )常用于合成叶酸,可用
)常用于合成叶酸,可用
所用实验装置如图(略去加热、夹持装置和部分仪器)。

操作步骤:
①向250mL的三口烧瓶中依次加入2.0550g对硝基甲苯,6.0g粉末及15mL水,在搅拌下滴入10mL浓硫酸(过量),并用冷水冷却;
②加热回流0.5h;
③待反应物冷却后,搅拌下加入40mL冰水,析出沉淀,抽滤;
④将③所得固体放入20mL5%硫酸溶液中,沸水浴上加热10min,冷却后抽滤并洗涤;
⑤将④所得固体溶于10mL5%NaOH溶液中,50℃温热后抽滤,在滤液中加入1g活性炭,煮沸,趁热抽滤;
⑥充分搅拌下将⑤所得滤液慢慢加入盛有60mL15%硫酸溶液的烧杯中,经“一系列操作”得产品,称重为2.0g。
部分物质的用量及物理常数如表:
药品名称 | 颜色状态 | 相对分子质量 | 熔点(℃) | 沸点(℃) | 水溶解性 |
对硝基甲醛 | 淡黄色晶体 | 137 | 51.3 | 237.7 | 不溶 |
重铬酸钾 | 橘红色结晶体粉末 | 294 | 398 | 500 | 易溶 |
对硝基苯甲酸 | 黄白色晶体 | 167 | 242 | 难溶 |
回答下列问题:
 +
+
已知:①高温焙烧后的产物为TeO2和Cu2O;
②Cu2O在酸性条件下会发生歧化反应;
③Te元素在酸化和碱浸后分别转化为TeOSO4和Na2TeO3两种易溶于水的盐。
回答下列问题:
a.离子键 b.配位键 c.氢键 d.σ键


i.![]()
![]() (g) ΔH1=-271.96kJ·mol-1
(g) ΔH1=-271.96kJ·mol-1
ⅱ.![]()
 (g) ΔH2=-267.80kJ·mol-1
(g) ΔH2=-267.80kJ·mol-1
回答下列问题:

①表示HCl转化率的曲线为(填“L1”或“L2”),理由为。
②T1温度下丙烯转化率最高的原因为。
③已知T2温度下,平衡时2-氯丙烷的体积分数为10%,则1-氯丙烷的体积分数为(保留两位有效数字,下同);反应i的平衡常数 [对于反应
,
, x为物质的量分数]。